摘要
简介
乙型肝炎相关代偿性肝硬化与肝细胞癌的高风险相关,抗病毒治疗是首选方法。由于肝纤维化的病理机制复杂,针对单一靶点开发的药物在临床实践中难以见效,目前临床上尚无疗效明确的化学药物或生物药物可供临床应用。中医是中国各族人民在几千年的历史长河中逐渐形成并不断丰富的一门医学。中医在肝病的治疗中,尤其是在肝纤维化的防治方面,表现出一定的疗效。本研究旨在检验中西医结合(中药加抗病毒治疗)对降低肝炎代偿性肝硬化患者肝细胞癌风险的有效性。
方法与分析
本研究为多中心随机对照试验,共有5家医院、802例患者参与。所有被试随机分为银七散黄解毒汤组(YQSHD) (n= 401)或安慰剂组(n= 401)。YQSHD组口服YQSHD颗粒联合恩替卡韦(ETV),安慰剂组口服YQSHD安慰剂联合恩替卡韦。治疗期52周,随访52±2周。主要预后指标是HCC的年发病率。将在基线和治疗后评估结果。这项试验的目标是“YQSHD与ETV的结合将HCC的年发病率降低到1%。”
伦理与传播
该方案已获得中国广安门医院医学伦理委员会(No.2019-006-KY)批准,其他试验中心在获得当地伦理批准后才开始招募。试验的最终结果将通过出版物发布。
试验注册
中国临床试验注册中心ChiCTR1900021532.2019年2月26日注册
背景
肝细胞癌(HCC)是全球癌症相关死亡的第二大原因,而肝硬化(LC)是HCC的主要危险因素[1].大多数慢性肝病都涉及肝纤维化,进一步发展可导致肝硬化,严重影响患者的健康和生命[1].一项前瞻性研究显示,慢性乙型肝炎(CHB)进展为LC的年发病率为2~10% [2].因此,积极治疗肝纤维化,逆转或延缓其发展,对改善疾病预后和患者的生活质量,具有十分重要的意义。核苷类似物(NAs)是大多数CHB患者的一线治疗选择,通过抗病毒治疗可降低hbv相关HCC的风险[3.].恩替卡韦(Entecavir, ETV)是一种推荐用于hbv相关肝硬化治疗的NAs,有报道称它可以缓解LC症状,改善患者预后,预防HCC的发展。据报道,ETV、拉米夫定(LDV)或替诺福韦(TDF)的长期治疗可将hbv相关肝硬化逆转为轻度纤维化[4].然而,在长期治疗过程中,耐药突变体的选择和肾毒性限制了其使用[5,6].因此,LC患者的治疗目标是最大限度地长期抑制HBV复制[7],减少肝细胞炎症坏死和肝纤维组织增生,延缓和减少肝功能衰竭、LC、HCC等并发症的发生,提高患者的生活质量,延长患者的生存时间,部分患者可寻求临床治愈[8,9].为了实现这些治疗目标,许多患者和内科医生寻求除抗病毒方法外的补充和替代疗法,如中医。
在中国,约85%的HCC是在LC基础上发生的,早预防、早诊断、早治疗是降低HCC发病率和病死率的关键[10].LC代偿期治疗的目的是控制病毒复制,抑制疾病进展,避免并发症,减少纤维化。目前尚无临床有效验证的抗肝纤维化药物,但中药在延缓疾病进展方面发挥了重要作用[11].一项研究表明,长期服用中药可降低CHB患者LC的风险,研究结果显示,中药服药者的肝硬化风险明显低于非中药服药者(调整后HR = 0.416,95%可信区间(0.231-0.749),组织学评价显示,中药使用者的纤维化改善率为45.0%,非中药使用者的纤维化改善率为11.1%(=0.033)。同时,通过对119个中药单方的分析,发现“补气健脾”、“清热祛湿”、“平肝理气”是中医治疗慢性乙型肝炎的主要方法[12].泻泻疏肝汤(ASD)是一种中药复方,通过抑制体内氧化应激和p65/Nrf2/JunD信号通路失调来改善肝毒性及相关肝功能障碍[13].有临床研究报道,中西医结合治疗(ETV +中药)可通过调节b细胞亚群分化,促进ETV部分缓解的CHB患者HBsAg水平的降低和HBeAg的清除;另一项临床研究显示,在伴有严重肝纤维化/肝硬化的CHB患者中,中药联合ETV治疗48周后,其坏死炎症改善率和纤维化消退率均高于单纯ETV治疗[14,15].以上研究证明中医在防治肝纤维化方面具有重要作用;但目前尚缺乏大样本、多中心随机对照研究,为中医药防治肝纤维化提供可靠、高水平的循证医学证据。
在中医理论中,LC的病机为本源虚;相应的,主要治疗原则为活血化瘀、强身健体、清热解毒、祛湿。YinqiSanhuang解毒汤剂(YQSHD)是一种中药复方,主要成分为黄琦(黄芪propinquusSchischkin。,Radix Astragali),阴陈(茵陈蒿研究。,virgate wormwood herb capillary wormwood herb), and so on, as shown in Table1.它显示了“清热”、“解毒祛湿”、“活血”、“化瘀”、“强身健体”的临床效果。它已经在临床使用多年,2018年,我们进行了一项临床观察性研究,招募了100名受试者。观察两组(联合组口服中药加ETV,对照组仅口服ETV) chb相关症状体征,如食欲不振、乏力、腰腹疼痛、体黄、腹胀、眼干、恶心、嗳气、面色暗沉、口干、口苦、便稀、夜尿频繁等;结果显示,随着治疗时间的延长,两组患者病情均有明显改善。此外,随着治疗时间的延长,两组患者谷丙转氨酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)、γ -谷氨酰转移酶(GGT)均显著下降,联合治疗组明显低于对照组。对照组ALT正常化率为52%,联合组为94%;在病毒学应答方面,对照组HBV-DNA转换率为62%,联合组为86%;两组之间的差异具有统计学意义[16].在之前的实验室研究中,我们通过腹腔注射40%的CCl建立了肝纤维化模型4(2 ml/kg)给Wistar大鼠注射4周,提取原代大鼠肝窦内皮细胞(LSECs)活细胞的三维成像,最大限度地逼真地呈现细胞在体内的生活状态。通过原子力显微镜(AFM)对细胞进行“触诊”,将生物药理学的概念引入研究。结果显示,在原子力显微镜曝光模式下,中药组(黄芪多糖(AP)干预后LSECs扩散更明显,且血清纤维化损伤后LSECs的杨氏模量高于对照组(杨氏模量的降低意味着细胞的刚性变小)。同时借助快速激光共聚焦荧光显微镜/全内反射荧光显微镜联合成像系统,观察AP对LSECs中NO分泌的影响。中浓度和高浓度AP溶液可以减缓LSECs中NO合成量的下降(这些结果尚未发表)。为了检验YQSHD联合ETV治疗代偿性肝纤维化的有效性和安全性,我们设计了本多中心、大样本随机对照盲法试验。这项研究的目的是将代偿性肝硬化转变为HCC的年发病率降低到1%。
方法
学习设置和招聘
将从10家医院共招募802名患者:负责单位为中国中医科学院广安门医院82例,杭州西溪医院80例,上海中医药大学附属曙光医院80例,青岛市第六人民医院80例,南京第二医院80例,南昌第九医院80例,北京顺义中医院招募80例,沈阳市第六人民医院招募80例,北京地坛医院招募80例,首都医科大学招募80例,成都中医药大学附属医院招募80例。
门诊病人是主要招募对象。海报和网上宣传,包括试验的简要介绍和研究人员的联系方式,也将用于招聘。在入组前,每位参与者都将获得完整和全面的测试程序、目的、潜在不良事件和预期益处的描述。所有受试者将在筛选期间进行评估,以测试他们是否符合纳入标准,并将通知他们可以随时退出试验。研究人员将获得潜在试验参与者或授权代理人的知情同意或同意。筛查评价包括一般情况、疾病相关症状和体征,以及相应的实验室检查,包括尿妊娠试验(育龄妇女)、HBV-DNA、HBsAg、HBsAb、HBeAg、HBeAb、HBcAb、肝功能、甲胎蛋白(AFP)、肝脏b超或MRI/CT等检查。
合格标准
入选标准
入选标准如下:
- 一)
乙型肝炎相关代偿性肝硬化患者
- b)
18到65岁之间
- c)
中医表现为肝滞脾虚湿证。(中医诊断标准参照《中华人民共和国中医临床诊疗国家标准》[17]和《肝硬化中西医结合诊疗医学共识》[18由中西医结合学会消化系统疾病专业委员会出版。)
- d)
自愿签署知情同意书
排除标准
排除标准如下:
- 一)
其他慢性肝病引起肝硬化的患者
- b)
急性和慢性肝炎、自身免疫性肝炎、原发性胆汁性肝硬化、原发性硬化性胆管炎、遗传代谢性肝病、药物性或中毒性肝炎、非hbv嗜肝病毒感染的酒精性肝病患者
- c)
孕妇或哺乳期妇女或计划在研究期间怀孕的妇女
- d)
对试验药物过敏的病人
- e)
无法配合研究的精神障碍患者或状态不稳定的癫痫患者
- f)
涉及心、脑、肺、肾、造血系统的严重全身性疾病患者
- g)
酗酒或其他不适宜入组的患者。对于那些已经在使用中医的患者,除非他们停止使用中医超过3个月,否则我们将不纳入他们
- h)
其他调查人员认为不适宜的情形
如果出现以下情况,受试者应中止试验:(a)依从性差,服药不规律,未复诊或按时复诊;(b)某些合并疾病或并发症,或试验期间病情恶化;(c)受试者自我退缩;(四)与其他药物合用或者未按照研究规定服用试验药物的;(e)失联;和(f)不能提供完整的信息。有具体的停止标准:(一)试验过程中发生严重安全问题,应及时停止试验;(b)在试验过程中发现该药物没有临床价值,应停止试验,以免延误受试者的有效治疗;(三)在试验中发现临床试验方案存在重大错误,难以评价药物疗效的;或设计良好的方案在实施中存在重大偏差,难以继续评价药物的疗效和安全性; (d) the funding supporter requested stopping (such as funding reasons, management reasons, etc.); (e) the State Food and Drug Administration of China ordered the trial to be stopped for some reason; (f) the test is suspended due to force irresistible reasons.
干预措施
试验组(YQSHD组)给予YQSHD配方颗粒5g(服前加水150-200ml冲泡),每日2次,联合恩替卡韦(H20100019,中国江苏嘉泰天庆药业)0.5mg,每日1次。对照组(安慰剂组)给予YQSH安慰剂配方颗粒5g(服前用水150-200ml冲泡),每日2次,联合恩替卡韦0.5mg,每日1次。YQSHD的主要成分,共14种草药,见表1.试验药物制成中药配方颗粒。YQSHD安慰剂由辅料、稀释剂、着色剂、调味剂、炸麦芽等组成,在形、色、香、味等方面与YQSHD相似。
其他抗病毒药物或临床疗效相似的中药在试验期间不得服用,如TDF或LDV,如果非抗病毒药物联合使用,应在“病例报告表(CRF)”中进行记录。如果受试者需要其他治疗或伴随护理,应提前与医生联系。
结果
主要的结果
主要终点为HCC的年发生率(检查项目包括甲胎蛋白(AFP)、肝脏b超检查或腹部MRI/CT成像)。
在治疗前、治疗期第52周和随访期第52±2周评估主要结局。
二次结果
次要结局包括hbv - dna阴性率、hbsag阴性率、HBeAg血清转转率、肝功能(ALT、AST、GGT、ALP、ALB、TBIL)、脾脏厚度、患者临床症状评价评分。
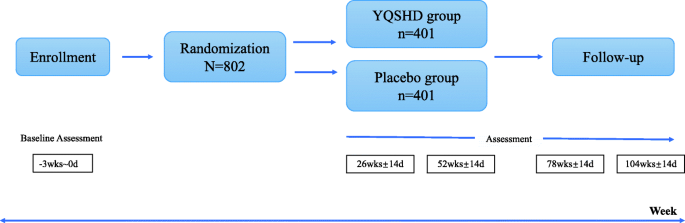
这些指标分别在治疗前、治疗期第26周、52周、随访期第26±2周、52±2周观察(图2)。1).
安全的结果
安全性结局包括不良事件(AE)、实验室检查(肝功能、肾功能、血常规、尿常规等)、心电图、基本生命体征、体检。
基本生命体征为体温(T)、血压(BP)、呼吸(R)、心率(HR);实验室检查包括肾功能检查、血尿素氮(BUN)、肌酐(Cr)、血液、粪便和尿液常规检查。从基线开始监测这些生物学指标,直到随访结束。2).
参与者的时间表
治疗期52周,随访52±2周。我们画了一个流程图,使时间轴更清楚(图。1).
样本大小
本研究的目的是将HCC的年发病率降低3~6% [2到1%的CHB患者。因此,根据两个样本率比较的样本量估计公式,目标事件的发生率小于0.2(或0.3)或大于0.8(或0.7),估计公式如下:
的pe而且pc分别为试验组(YQSHD组)和安慰剂组(对照组)的发病率;阳性事件率(pc)为5%,而目标事件率(pe)为1%。由于和的值很小,所以用弧度来衡量度数,α= 0.05,β= 0.10。在这项研究中,我们选择了双侧测试,u0.05= 1.96, = 1.282,pe= 0.05,且pc= 0.01。每组的计算样本量约为334例,允许20%的减员;因此,本次试验所需患者总数为334 × (1+20%) × 2 = 802例,每组401例。
分配
序列生成和实现
本研究采用中央随机化系统(CRS)对整个随机化方案的分配进行集中控制。随机化系统主要包括:受试者筛选、随机化、紧急盲法、药物配制、药品供应管理等功能模块。中心随机原则:研究者使用筛选模块输入受试者的一些基本信息(如出生日期、性别),获得受试者的唯一识别号码(SIN)。首先,确认符合纳入标准的患者,登录CRS,输入受试者基本信息,生成随机数,填写电子病例报告表(eCRF)。其次,药品经销商根据随机数字向CRS申请药品编号。最后,送药员将药品包装上的代码与系统中的号码进行核对,药品就已经发给患者了。
隐藏机制
使用“中心随机化”方法来隐藏分配:当研究人员确定受试者符合标准时,研究人员登录到中心随机系统,输入受试者的一些基本信息,并获得受试者的SIN。然后,中央随机系统根据设计的盲表分配受试者随机数和药物编号。为了使盲法有效,减少药物损失,将随机数与药物号分离,但系统内对应的治疗方案是一致的。
致盲和紧急开盲
这是一个双盲试验。盲法由天津中医药大学医学统计中心建立并实施。研究人员和受试者都不知道药物分组。在试行过程中,形成了科学严格的管理实施体系和可行的操作方法。对所有受试者进行规范观察,并仔细记录其临床症状。仔细观察不良反应,严重不良反应需“紧急开盲”。定期监督、检查、返还制度是双盲法实施的保障。
揭盲将在测试结束时对所有数据进行统计分析。结果评估采用盲法。当所有研究数据录入并锁定后,保存盲码的第三方参与者将与研究人员共同进行解盲,并将数据库提交给统计分析师。当所有的统计分析完成后,研究人员将撰写统计分析报告和临床试验总结。
数据收集和管理
研究者将为每位随机进入研究的受试者准备原始文件,并将信息记录在CRF中。所有在原始病历中出现的研究结果(包括个人资料、检测文件等)将在法律允许的范围内完全保密。CRF将显示姓名首字母和随机数,而不是全名。内容应全面准确,以便记录所有检查结果和其他相关数据。研究中心应在研究结束后妥善保存5年。研究人员将授权相关监管机构直接访问所有与研究相关的文件。
统计分析方案
结果
对于两组间主要结局发生率比较的统计分析,我们将使用χ2测试和设置P<0.05(95%可信区间)有统计学意义;对于次要结果:其中测量数据以均数±标准差表示,计数数据以频率和百分比表示(f, %),功效评价指标的频次或百分比折算为频次和百分比(f, %)。为了比较两组之间的平均值,首先进行同质性检验。如果方差相等,则t使用Test。如果不丢弃,则非参数化t' test被使用。采用配对法比较各组治疗前后的测量数据t/t的测试。网格表计数数据的比较是使用χ2检验,和秩数据的比较采用秩和检验。P以< 0.05为统计学差异。数据分析采用SPSS 19.0统计软件进行。
基线定义为首次用药前的最后一次观察数据,包括人口统计学特征和临床基线数据:年龄、性别、生命体征(身高、体重、体温、心率、血压、呼吸)、临床症状评分、HBV-DNA、AFP、恩替卡韦治疗史、chb相关疾病。
分析人口和缺失数据
全分析集(FAS)
根据ITT (intentional therapy)原则,所有随机受试者的数据将进入完整的分析集。对于因各种原因提前退出研究的受试者,将采用最后一次观察结转(LOCF)的方式进行补全。
每个协议集(PPS)
进入研究并完成治疗和随访的患者,用药依从性为80-120%,研究期间无影响疗效评价的联合用药,评价指标数据完整,无重大试验方案违规,其指标数据构成本研究的方案集。
安全集(SS)
安全集(SS)包括随机分组后接受至少一次治疗的受试者。
我们目前没有计划进行亚组分析或敏感性分析。
随访损失的处理有原则:(a)如果受试者损失是由于不良反应造成的,将数据记录在不良反应统计中;(二)如因无效而造成的损失,则有关资料会纳入效能统计;(c)对于治疗期间有效但不能完成整个疗程的患者,以及失去随访的患者,这些数据将纳入疗效统计,并应进行有意分析。
同意,伤害和AE
当患者同意参加试验时,受试者将签署两份知情同意书,分别由患者和研究人员保存。对于符合标准但非自愿或不完全自主的受试者,经伦理委员会同意也可进入试验,知情同意书由其监护人签署。
在治疗和随访期间发生的任何不良医疗事件,无论与试验药物是否存在因果关系,都应被视为不良事件(AE),并记录在CRF指定的不良事件表中。在填写声发射报告表时,应详细记录声发射的发生情况、发生时间、严重程度、持续时间、采取的措施和结果。如果在试验过程中发生严重不良事件,应立即采取紧急处理,并在24小时内报告试验负责人、伦理委员会和中国国家食品药品监督管理局安全监督部门。对所有不良事件进行跟踪,直至不良症状消失或研究人员确认不再需要进一步随访。
若受试者在治疗过程中发生与本研究直接相关的损伤,且经医学鉴定确认,研究组将支付受试者医疗费用;对于因药物伤害引起的严重AE,课题组将按照国家相关法律法规给予受伤受试者一定的赔偿,赔偿费用由广安门医院承担。
监控和审核
数据监测委员会(DMC)的组成将根据相应的标准操作程序对试验进行监测,该委员会独立于研究人员。DMC将被允许评估研究的质量和完整性。在本试验开始前,应对所有临床试验研究人员进行统一的培训,包括良好临床规范(GCP)、研究方案、电子数据采集系统(EDC)、中心随机系统和量表的使用。DMC将评估研究中心的能力,并收集有关机构设施和技术设备的信息。在研究期间,DMC负责将临床研究记录与原始记录进行核对,并解决试验过程中出现的任何问题。DMC还将监督研究中心遵守研究方案,安排研究药物的供应,并确保药物按照指示保存在适当的条件下。各中心应将主要指标提交临床终点委员会,由统一标准进行评价。首席研究员和授权研究员应审查eCRF,电子签署并注明日期。DCM有权查看中期结果,并与研究人员一起做出终止试验的最终决定。
依从性
在试验开始时,研究人员会强调受试者依从性的重要性,并要求受试者在访问研究中心时带回药物包(无论剩余药物)。同时,我们将建立在线平台,与患者即时联系,每月至少与患者联系两次,了解患者情况,提醒患者积极回诊。对于治疗期间有效但不能完成整个疗程的患者,以及失去随访的患者,这些数据将纳入疗效统计,并进行有意分析。
自第一名患者入组以来,每个研究中心每3个月接受一次审核访问。该研究将由临床研究助理(CRA)按照相应的标准操作程序进行定期监测,他们将帮助监测是否已获得所有受试者的书面同意和有日期的知情同意书(ICF)。专业的医学审查将病例报告表格(CRF)或eCRF中输入的数据与原始数据进行比较,以确保数据的质量、临床逻辑和一般医学术语的描述。研究人员将妥善保管数据,以保护受试者的权利和隐私,临床试验中的文件按照GCP的要求进行保存和管理,数据库由EDC维护。审计程序独立于调查人员。
讨论和潜在限制
有研究报道,未接受抗病毒治疗的CHB患者中,肝硬化的年发病率为2-10% [2],一项多中心队列研究显示,服用恩替卡韦的乙肝病毒患者的肝癌年发病率为1.7% [3.].与此同时,研究表明联合治疗优于常规抗病毒治疗[19,20.,21],不仅能增强抗病毒能力,另一方面还能减轻伴随症状,提高生活质量,延长患者生命[22,23].因此,联合治疗有望成为慢性乙型肝炎治疗的趋势。要达到高效度和高信度,必须有严格的质量控制和高质量的方法。为了促进适当的高质量方法和严格的质量控制,本协议已根据CONSORT声明[24]及SPIRIT 2013 [25].本试验基于一线抗病毒药物ETV联合中药复方YQSHD。这是一项多中心、随机、双盲、安慰剂对照试验,目的是将乙肝相关代偿性肝硬化患者的年度肝癌发病率降至1%。本试验的结果可能为YQSHD的有效性和安全性提供证据。
这项研究也有一些局限性,值得考虑。由于研究项目经费和试验期的限制,随访时间不能更长,很遗憾我们无法获得3年、5年甚至更长时间的随访数据。此外,对于联合治疗,仍有一些问题需要明确,如什么时候联合治疗最好,停药后是否可以重复。尽管存在这些局限性,本研究的结果将从一个设计良好的试验中提供关于YQSHD的新证据。此外,本研究将根据中西医结合实践中肝纤维化诊断和治疗指南(2019),为成人CHB提供一种中药处方[26].
试验状态
该协议版本号为1,于2018年10月最终确定。本方案已在中国临床试验注册中心(NO。ChiCTR1900021532;URL:http://www.chictr.org.cn/searchproj.aspx).招聘日期于2019年10月23日开始。原计划完成招聘日期约为2021年12月;然而,由于COVID-19在全球的突然流行,这将严重影响我们的招生,导致结束日期比我们预期的要晚。如果需要修改方案,我们将与调查人员、伦理委员会、试验登记处和其他相关方进行沟通。
伦理与传播
该方案已获得中国广安门医院医学伦理委员会的批准(这是中央伦理批准),其他试验中心将在获得当地伦理批准后才开始招募。试验的最终结果将通过出版物发布。
试验注册
ChiCTR1900021532,该方案已在中国临床试验注册中心注册(网址:http://www.chictr.org.cn/searchproj.aspx), 2019年2月26日。
数据和材料的可用性
这是一篇开放获取文章,允许其他人以非商业的方式分发、混音、改编、在此基础上进行构建,并以不同的条款许可他们的衍生作品,前提是原始作品被正确引用并且使用是非商业性的。试验的最终结果将通过出版物发布。
缩写
- AE:
-
不良事件
- ALT:
-
丙氨酸转氨酶
- AST:
-
天冬氨酸转氨酶
- 高山:
-
碱性磷酸酶
- 铝青铜:
-
血清白蛋白
- 治疗组:
-
总胆红素
- 包子:
-
血尿素氮
- 慢性乙肝:
-
慢性乙型肝炎
- CRS:
-
中央随机化系统
- CRF:
-
病例报告表
- 化学加工:
-
中草药
- DAAs:
-
抗病毒药物
- DMC:
-
数据监测委员会
- 心电图:
-
心电图
- ETV:
-
恩替卡韦
- 食品药品监督管理局:
-
食品和药物管理局
- 乙肝病毒:
-
乙型肝炎病毒
- 肝细胞癌:
-
肝细胞癌
- LC:
-
肝硬化
- 质量:
-
良好临床实践
- GGT:
-
Gamma-glutamyl转移酶
- 干扰素:
-
干扰素
- NAs:
-
干扰素有(t) ide类似物
- 罪:
-
受试者的唯一识别号码
- 中医:
-
中医
- YQSHD:
-
银七三黄解毒汤
参考文献
Trautwein C, Friedman SL, Schuppan D, Pinzani M.肝纤维化:概念到治疗。中华肝病杂志,2015;42(1):15-24。https://doi.org/10.1016/j.jhep.2015.02.039.
Fattovich G, Bortolotti F, Donato F.慢性乙型肝炎的自然史:特别强调疾病进展和预后因素。中华肝病杂志,2008;48(2):335-52。https://doi.org/10.1016/j.jhep.2007.11.011.
苏金,叶全,徐玉生,等。长期恩替卡韦治疗期间乙型肝炎病毒相关肝细胞癌风险随时间变化趋势的多中心研究中国病原生物学杂志,2020;27(12):1352-8https://doi.org/10.1111/jvh.13384.
张婷婷,廖玉峰,吴世生,薛夫,韩克勤,赖春林,等。长期恩替卡韦治疗可逆转慢性乙型肝炎患者的纤维化/肝硬化和持续的组织学改善。国际肝病杂志,2010;52(3):886-93。https://doi.org/10.1002/hep.23785.
孙德杰,朱丽娟,姚德华,等。潜在抗乙型肝炎病毒制剂的最新进展:结构和药理观点。欧洲医学化学杂志,2018;147:205-17。https://doi.org/10.1016/j.ejmech.2018.02.001.
李硕,千桂杰,金海生,金善生,郑文伟,等。对核苷耐药HBV拉米夫定-阿德福韦治疗反应不佳的患者,替诺福韦单药治疗优于恩替卡韦-阿德福韦联合治疗:一项96周的前瞻性多中心试验。抗病毒治疗。2018;23(3):219-27。https://doi.org/10.3851/IMP3169.
王晓明,王志强,王志强,等。慢性乙型肝炎的预防、诊断和治疗更新:AASLD 2018乙型肝炎指南。肝脏病学。2018;67(4):1560 - 99。https://doi.org/10.1002/hep.29800.
欧洲肝脏研究协会。EASL 2017乙型肝炎病毒感染管理临床实践指南。中华肝病杂志,2017;67(2):370-98。
麦丽丽,Seto WK, Fung J, Yuen MF。乙型肝炎的新发展:治疗目标、药物和监测工具。临床药物学杂志,2019;12(2):109-20。https://doi.org/10.1080/17512433.2019.1567327.
周杰,孙华,王忠,等。中国原发性肝癌诊疗指南(2017年版)。《中国原发性肝癌诊疗指南(2017版)》,2018,7(3):235-260。https://doi.org/10.1159/000488035.
南玉梅,孔丽玲。中西医结合诊断与治疗肝硬化的研究进展。中华肝病杂志,2018;26(5):328-31。https://doi.org/10.3760/cma.j.issn.1007-3418.2018.05.003.
侯震,张静,张旭,等。长期中药联合NA抗病毒治疗对现实环境中慢性乙型肝炎肝硬化发病率的影响:一项回顾性研究循证补体交替医学2020;2020:3826857 - 8。https://doi.org/10.1155/2020/3826857.
孙玉峰,潘海辉,沈帅,夏智,于智,李春林,等。泽泻疏肝汤(ASD)通过抑制氧化应激和p65/Nrf2/JunD信号通路失调来改善肝毒性和相关的肝功能障碍。医学科学通报。2020;26:e921738。https://doi.org/10.12659/MSM.921738.
李敏,周振华,鲍涛,张旭,朱新军,金光生,等。补肾方联合引诱昔韦通过调节B细胞分化对引诱昔韦反应次优的慢性乙型肝炎患者的有益作用。中国生物医学工程学报。2018;48(2):633-43。https://doi.org/10.1159/000491891.
桂海林,赵长青,王勇,顾海涛,王文杰,蔡伟,等。扶正化瘀联合恩替卡韦治疗慢性乙型肝炎合并明显肝纤维化的组织学结果。中华临床肝病杂志,2020;8(3):277-84。https://doi.org/10.14218/JCTH.2020.00004.
王德平。银气三黄解毒汤联合恩替卡韦治疗慢性乙型肝炎的临床研究[D]。北京中医药大学学报,2018;1-66。
国家技术监督局。中华人民共和国中医临床诊疗国家标准:症状部分第4卷。北京:中国标准出版社;1997.55页。(中国)
中国中西医结合学会消化系统疾病专业委员会。中西医结合诊断和治疗肝硬化的共识。《中国消化中西医结合杂志》第19卷;2011.277 - 9页。(中国)
何敏,吴勇,王敏敏,等。氧化苦参碱对慢性乙型肝炎持续病毒学应答临床价值的meta分析。中华肝病杂志,2016;15(4):482-91。
张玲,舒朋。中医治疗纤维化肝病:希望与炒作。中华肝病杂志。2014;61(1):166-8。https://doi.org/10.1016/j.jhep.2014.03.009.
康宏,赵颖,李超,陈勇,唐凯,杨林,等。将临床指标整合为四诊信息有助于慢性乙型肝炎中医证候诊断。中华临床医学杂志2015;5(1):9395。https://doi.org/10.1038/srep09395.
陈建新,徐庆祥,王建华,等。复发性肝细胞癌经中药治疗病灶完全缓解1例。中国癌症杂志,2017;16(4):597-604。https://doi.org/10.1177/1534735416660617.
熊霞,杨霞,刘颖,张颖,王萍,王杰。中医治疗高血压的中药方剂:现代科学视角。Hypertens Res. 2013;36(7): 570-9。https://doi.org/10.1038/hr.2013.18.
Moher D, Hopewell S, Schulz KF, Montori V, Gotzsche PC, Devereaux PJ,等。CONSORT 2010解释和阐述:报告平行组随机试验的更新指南。BMJ。2010; 340 (mar23 1): c869。https://doi.org/10.1136/bmj.c869.
陈伟林,陈伟林,陈伟林,等。SPIRIT 2013解释和阐述:临床试验方案指南。BMJ.2013; 346 (jan08 15): e7586。https://doi.org/10.1136/bmj.e7586.
徐立明,刘鹏,沈学泽,等。中西医结合诊疗肝纤维化指南(中国,2019版)。中华中西医结合杂志2019;27(11):494-504。
确认
我们感谢所有参与的患者对我们诊所和研究的信任。
患者和公众参与声明
让患者或公众参与我们研究的设计、实施、报告或传播计划是不合适的,也是不可能的。
资金
本项目由国家重点研发计划项目(No. 2018YFC1705700)资助。该资金来源在本研究的设计中没有任何作用,在其执行、分析、数据解释或提交结果的决定中也不会有任何作用。
作者信息
作者及隶属关系
贡献
L-WL对这一理念进行了概念化和批判性的修改,并提供了专业的建议。W-QJ写了这份手稿的初稿。所有作者都阅读并批准了最终的手稿。L-JM、Z-TT、Z-Q、W-JC、W-QN、C-ZM等参与了稿件的构思设计、统计建议和最终审定;我们对这些活动有最终的权力。
相应的作者
道德声明
伦理批准并同意参与
该方案已获得中国广安门医院医学伦理委员会的批准(这是中央伦理批准),其他参与试验的医院将在获得当地伦理批准后才开始招募。所有研究参与者将签署两份知情同意书,一份由患者保存,另一份由研究人员保存。这项研究的结果将发表在同行评议的期刊上。
发表同意书
根据知情同意的条款,除非获得受试者的同意,否则受试者的所有个人信息都是保密的,不会向公众披露。必要时,药品监督管理部门、伦理委员会或项目资助部门可以查阅受试者的数据。如果未经允许,他们不会将受试者的信息用于其他目的或透露给其他团体。
相互竞争的利益
所有作者都宣称他们没有竞争利益。
额外的信息
出版商的注意
怎么样下载亚搏施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
吴,QJ。,Lv, WL., Li, JM.et al。银七散黄解毒汤治疗乙型肝炎代偿性肝硬化:一项多中心随机对照试验研究方案试用22, 701(2021)。https://doi.org/10.1186/s13063-021-05650-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13063-021-05650-6