摘要
背景
由于成本、毒性、治疗时间过长或寄生虫耐药性的出现,东非针对内脏利什曼病的治疗方案远不能令人满意。因此,有必要探索替代治疗方案,如单独使用米替福辛或联合使用米替福辛、噻伯格葡萄糖酸钠(SSG)或两性霉素b脂质体。本试验的目的是确定在东非未来试验中有足够前景的方案。
方法/设计
一项II期随机、平行组、开放标记试验正在进行,以评估三种方案中的每一种的疗效:脂质体两性霉素B联合SSG、脂质体两性霉素B联合米替福辛和单独米替福辛。主要终点为28天治愈,次要终点为210天(6个月)。初步治疗是基于寄生虫学评估(骨髓、脾脏或淋巴结抽吸)和临床评估的单一综合措施。在每组招募15例患者,每组最大样本量为63例后,已计划重复中期分析。这些测试将遵循群体顺序方法(三角测试),以确定方案何时不足(<75%功效)或适当(>90%功效)。我们描述了一种确保第28天治愈的顺序分析与第210天治愈的非顺序分析的一致性的方法。
讨论
具有足够疗效的方案将是治疗VL的候选方案,且费用合理。该设计允许在整个试验招募期间重复测试,同时保持良好的统计特性(I型和II型错误率)并减少预期样本量。
试验注册
ClinicalTrials.gov:NCT01067443
背景
内脏利什曼病(VL)或黑热病是所有利什曼病感染中最严重的,如果不及时治疗会致命[1].VL的一个并发症,特别是在苏丹,是后黑热病真皮利什曼病(PKDL),患者的脾脏、骨髓或淋巴结中没有可检测到的寄生虫,但会出现可检测到利什曼原虫的黄斑和丘疹性皮肤病变。PKDL发生的中位时间为治疗后6个月[2].
由于成本的原因,东非可用的单一治疗方案远不能令人满意(脂质体两性霉素B®)、毒性(噻博格葡萄糖酸钠,SSG)或延长治疗时间(一个月,SSG),导致依从性和可能出现的寄生虫耐药性的额外担忧。在东非,不论是单药治疗还是与SSG联合使用的Paramomycin最近刚刚完成了开发。然而,在该地区将其用于单一疗法似乎并不现实[3.,4].这就需要探索新的治疗方案,包括米替福辛单药疗法和将不同作用模式的药物(如SSG、脂质体两性霉素B)结合起来的替代联合治疗算法®米替福辛可以提供新的治疗选择,由于所需剂量和治疗时间的减少,以及耐药性出现的风险较小,可以提供合理的费用[5].
30天斯蒂博格葡萄糖酸钠目前是东非VL治疗的主要方法。脂质体两性霉素B®也被用于野外,但主要是作为VL的抢救治疗。使用米替福辛的经验有限,该地区尚未注册:仅可从埃塞俄比亚进行的一项研究获得数据,该研究在HIV阴性患者的6个月随访中证明米替福辛单药疗法的疗效为93% [6].所有三种药物都已在印度进行了研究并注册,米替福辛(28天疗程)的IV期研究已完成[7,8].此外,在印度进行的一项iii期研究评估了3种短期疗程组合,包括Ambisome +米替福辛7天,6个月的疗效为97% [9].
本研究旨在研究潜在可行的短期联合疗法,并评估和可能登记米替福辛在苏丹和肯尼亚的VL的常规剂量和方案。它还旨在为东非的VL患者(包括儿童)提供米替福辛的药代动力学,对他们来说,在全球范围内这类信息很少。这是对两种潜在组合的有效性和安全性的ii期概念验证研究。
方法/设计
研究设计
II期开放标签随机对照临床试验。
主要目标
评估以下治疗方法对第28天原发性VL的疗效:
单剂量两性霉素B脂质体联合使用®以及10天的SSG课程
单剂量两性霉素B脂质体联合使用®10天的米特福辛疗程
米特福辛28天疗程
设置
这两个试验点的地区是VL的流行地区。它们是苏丹格达里夫州杜卡医院和肯尼亚巴林戈区基马勒尔医院。将考虑增加另一个苏丹地点。数据被带到位于肯尼亚内罗毕的研究协调中心的数据中心。该试验由利什曼尼亚东非平台(LEAP:http://www.dndi.org/leap-platform)与试验地点合作,并由被忽视疾病药物组织赞助倡议(http://www.dndi.org).
结果测量
主要的结果
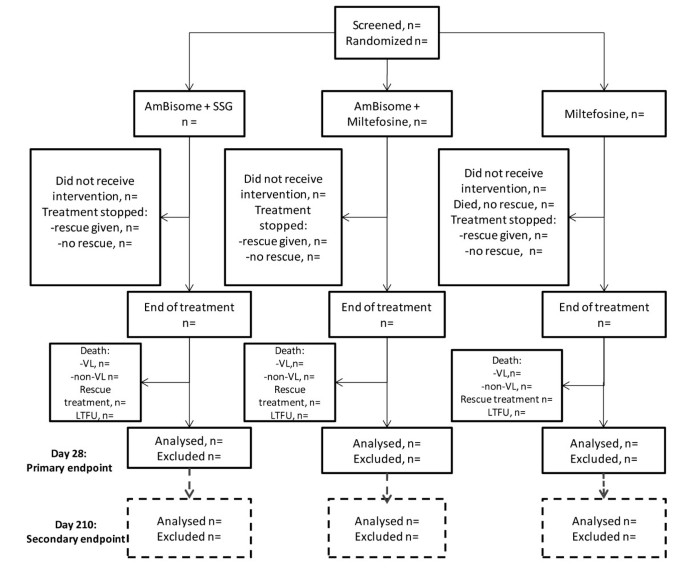
主要终点为初始治愈,评估于第28天(图1)基于临床评估和寄生虫学评估(苏丹为骨髓或淋巴结,肯尼亚为骨髓或脾脏抽吸)。
二次结果
最终治愈,定义为根据临床评估在第210天(6个月随访)治愈的患者百分比,仅在根据标准化临床评估进行临床指征时进行寄生虫学检查。
不良事件和严重不良事件发生在三个研究组,直到第60天。
描述所有三个臂的药效学性质。
米替福辛单用及与两性霉素B脂质体合用的药代动力学特性描述®.
分配
生成随机化序列,按数据中心预先确定的块大小按站点分层。在试验地点,随机化代码使用密封的、按顺序编号的不透明信封向研究人员隐藏。随机化列表的副本安全地存储在数据中心。信封外部按顺序编号。在每一个里面都有一个随机化表,有相同的序列号以及治疗分配。这些随机化表归档在源文件中,监测员在每次现场访问时验证这些文件,以确认为每位患者只打开了一个信封,以确保随机化过程的完整性。
干预措施
脂质体两性霉素B®第1天给药,剂量为10mg /kg体重,注入5%葡萄糖,持续1-2小时。
米替福辛口服剂量为每天2.5 mg/kg体重,单独使用时最高可达150 mg,持续28天。
米替福辛口服剂量为每天2.5 mg/kg体重,最高可达150 mg,从单次剂量脂质体两性霉素B后的第2天开始,持续10天®10毫克/公斤。
SSG在单剂量两性霉素B脂质体后的第2天开始,以每日一次20mg /kg体重的剂量静脉注射/IM,持续10天®.
因此,给药方案如下
脂质体两性霉素B®第1天,一次剂量为10mg /kg体重(IV),然后从第2-11天开始,以20mg /kg体重(IV/IM)给药10天。
脂质体两性霉素B®第1天给药10mg /kg体重(IV),随后从第2-11天开始给药10天,剂量为2.5 mg/kg体重(口服)。
米替福辛单药疗程,2.5 mg/kg体重(口服),从第1-28天开始。
所有不符合规定的情况都将记录在CRF的试验用药页面上。
筛选
入选标准
有VL临床症状(发热至少2周,脾肿大),并通过显微镜下组织样本中寄生虫可见确诊的患者,年龄7至60岁(含),签署书面知情同意书,HIV阴性。
排除标准
在过去6个月内接受过抗利什曼原虫药物的患者/复发病例,淋巴结/骨髓或脾脏涂片阴性,严重蛋白质和或热量营养不良,既往对SSG或男女霉素B过敏反应史,伴有严重感染(如结核病)或其他严重基础疾病,妨碍评估患者对研究药物的反应,患有血吸虫病、心律不齐病史或心电图异常、育龄女性(怀孕或哺乳期)、血红蛋白< 5mg /dL、白细胞<1 × 10等与脾肿大相关的其他疾病3./毫米3.,血小板< 40000 /mm3.肝功能检查(ALT、AST)异常超过正常范围上限3倍以上,血清肌酐超出年龄、性别正常范围,入组前两周内进行重大手术干预。这些测试是标准化的,但由于使用的仪器和试剂不同,常规临床实验室评估的标准化是不可行的。但是,内部和外部QC将在两个站点定期进行,并在试验开始和试验期间对站点工作人员进行培训,以确保收集的数据是可靠的和可比较的。
艾滋病毒状况和VCT
向所有患者提供艾滋病毒咨询和筛查(自愿咨询和检测计划)。这是在获得纳入试验的同意的同时进行的。根据国家治疗指南,拒绝VCT或被发现为HIV阳性的患者没有资格参加这项试验,但可以接受适当的治疗。此外,根据国家艾滋病毒阳性患者方案,将他们转介接受治疗、监测和随访。
同意
目前正在使用符合当地情况并翻译成当地语言并经伦理委员会批准的标准化同意书。签名或指纹是为了获得同意,后一种情况下,成年人需要证人(文盲受试者)。在儿童的情况下,一旦获得儿童的父母或监护人的许可,调查人员就会得到他们的同意。
根据国家治疗指南,不符合纳入标准或不同意的患者在试验外可获得免费治疗。
分析和样本量
主要终点分析:28天治愈
本研究的设计和分析将根据组序方法,特别是三角检验[10- - - - - -12].根据试验的主要目标,分析的目的是有效地确定a)不充分,因此可以停止开发,或b)充分,因此可以继续开发的方案。在这些情况下,本试验中被认为不充分的最高疗效(即按主要结果治愈的患者百分比)被设定为75%(记为p0),最低疗效为90%(记为p一个).零假设和备择假设是H0:p≤p0而且H1:p>p一个分别。
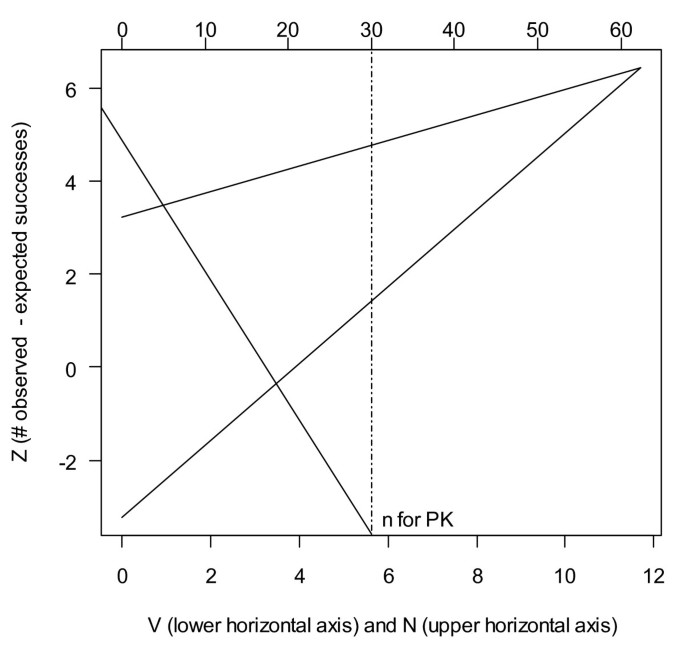
三角形停车边界,如图所示2,根据Ranque等[10].I型和II型错误率设置为5%(功率95%),每组每15例患者后进行序列分析,所需的最大样本量为189(每组63例)。实际样本量可能小于此值,这取决于治愈患者的实际百分比何时会导致跨越边界。边界的计算使用R软件中定制编写的函数[13],检查了他们是否可以重现Ranque等人的例子[10].
每次分析都包括量的计算V(与当前样本量成正比)和Z(观察到的处理成功数减去预期的处理成功数),并将其绘制在图中2.因此,对于每条手臂,一条从原点开始的直线随时间被绘制出来。当这条线穿过三角形区域的任何一个边界时,手臂的补流将停止。越过下边界或上边界意味着分别得出不足或充足的结论。由于这三个兵种将分别进行评估,因此其中一个兵种可能会先于其他兵种停止。
上述程序受到试验的PK部分的限制,它需要至少30名患者在第2组和第3组,但疗效不充分。因此,如果上边界在n= 15(表示有足够的疗效),该手臂将继续,直到n= 30。但是,如果越过了下限(表示功效不足)n= 15,则停止。
跨越区域边界意味着治愈率大于90%(跨越上边界)或不超过75%(跨越下边界)。疗效的最大似然估计,即治愈人数除以患者人数,由于试验的顺序性质,是一个有偏的估计量。考虑到这一点,分析将遵循Bellissant等人[11].首先,样本量C *将按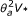 ,在那里V *的终端值是V从数据样本,和θ一个参数为对数比值θ=日志e(p(1 -p0) /p0(1 -p))p=p一个.然后,Whitehead的附录A中的表格[12],得到检验的显著性水平,得到的点估计和区间估计p.后者是用乘数来表示的θ一个.最后,这三个值θ(即点估计值和上、下置信限)将转化为对应的样本值p通过p= (p0eθ) / (1 +p0(eθ1))。分析将使用STATA [14].
,在那里V *的终端值是V从数据样本,和θ一个参数为对数比值θ=日志e(p(1 -p0) /p0(1 -p))p=p一个.然后,Whitehead的附录A中的表格[12],得到检验的显著性水平,得到的点估计和区间估计p.后者是用乘数来表示的θ一个.最后,这三个值θ(即点估计值和上、下置信限)将转化为对应的样本值p通过p= (p0eθ) / (1 +p0(eθ1))。分析将使用STATA [14].
次要终点分析:210天治愈
上述序贯分析仅与第28天的疗效有关,与第210天无关。然而,由于后者很可能与前者高度相关,在后面的分析中忽略顺序设计可能会给出不一致的结果。例如,如果所有患者在第210天的状态与第28天相同,那么使用不同的分析方法将从相同的数据得出不同的疗效估计。这是因为第28天的估计考虑了顺序设计,一般来说,顺序设计与第210天对相同数据进行的常规分析不同。
因此,第210天的功效将通过考虑两个连续时间段的事件来估计:到第28天,以及从第28天到第210天。更具体地说,第210天的疗效(即治愈的百分比或p210)将被视为两个概率的和,如下所示:
- 我)
在第28天治愈并在第210天保持治愈的概率。
- (二)
第28天未治愈但第210天治愈的概率。
这些概率中的每一个都是两项的乘积,并且可以进行点估计p210:
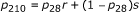
地点:
r是在第28天被治愈的人在第210天仍然被治愈的百分比。
年代是那些在第28天没有痊愈的人在第210天痊愈的人的百分比。
的抽样方差估计置信区间p210.使用“delta方法”[15],这可以估计为抽样方差的函数p28,r而且年代;这三个量在统计上是独立的。的抽样方差p28将被估计为其标准误差的平方,这反过来将被估计为其95%置信区间的宽度除以2 × 1.96,使用正态近似。的抽样方差r而且年代将通过将它们视为标准二项比例来估计。
上述过程确保,例如,如果在第28天到第210天之间没有患者改变治愈状态,则点估计为p28而且p210会相等(因为r= 1和年代= 0)。然而,置信区间通常是不相等的。这是因为将第28天到第210天之间的进展作为一个单独的变量意味着额外的抽样变化。例如,r即使在等于1时也有抽样变化。此外,抽样变化是在概率尺度上考虑的,而不是对数概率尺度p28.这也意味着计算的置信区间可能超过区间0-1。在这种情况下,它将在该间隔的极限处被截断。
当分析结果显示停止某一臂时,也将评估最终治愈率(第210天)(当所有患者都达到该时间点时)。如果发现第210天治愈率的点估计值<90%,则不考虑该组(第1和第2组)进行进一步研究(例如3期)。
在每个臂内,每个时间点的固化百分比将按部位显示。卡方检验或Fisher精确检验将用于在5%显著性水平下检验各试验点在主要和次要疗效终点方面的差异。
评估时间表和预期副作用
评估时间为第0天、第3天、第7天、第14天、第21天、第28天、第60天和第210天1),并包括临床、寄生虫学、血液学、生物化学和药代动力学评估(表1).基线评估包括人体测量、临床和实验室评估。第60天和210天的评估由于患者的旅行需要在日期上有一定的灵活性,每个评估的访问窗口如下-第60天(+/- 10天)和第210天(+/- 21天)。
救援药物
给予救援药物的决定是基于所有试验点的标准指南。任何接受挽救性药物治疗的患者,如果在最初治愈时(第28天)或之前接受了挽救性药物治疗,则被认为是初始治愈时的治疗失败;如果在最终治愈时(第210天)或之前接受了挽救性药物治疗,则被认为是最终治愈时的治疗失败。
救援治疗包括:
脂质体两性霉素B 30毫克/公斤IV分多次剂量(根据国家方案:苏丹- 3毫克/公斤/天,连续10天)
SSG 20 mg/kg IM 30-60+天:用于对初始抢救治疗无反应的患者或需要治疗的严重PKDL患者。
后黑热病真皮利什曼病(PKDL)
内脏利什曼病的并发症,特别是在苏丹,是后黑热病真皮利什曼病(PKDL)。PKDL的特点是皮肤损伤,通常发生在VL患者治疗后的几个月内。在第0、28、60和210天密切监测患者的PKDL情况。根据皮疹的典型外观和分布,将在临床上进行诊断。
伴随药物
在研究过程中,为患者健康所必需的伴随药物是允许的。在研究过程中所服用的所有伴随药物的细节都记录在CRF中,包括适应症、每日剂量、给药途径和日期。
辅助研究
药物动力学
VL疾病和地理差异对米替福辛药代动力学(PK)的影响在很大程度上仍然未知,大多数可用的PK数据来自一个相对健康的欧洲皮肤利什曼病(CL)患者组[16].米替福辛在成人VL患者中的彻底PK研究尚未发表,更不用说在儿科患者中了,东非地区也没有这样的数据。本研究将描述米替福辛在单药治疗组和联合治疗组的成人和儿童(7岁)药代动力学特征。两性霉素B脂质体和米替福辛之间任何显著的药代动力学相互作用将在联合治疗组进行评估。
米替福辛的生物分析将在治疗和随访期间对50 ~ 250 μL的血浆样本进行(见表2)1),使用经验证的液相色谱串联质谱法(LC-MS/MS)测定米替福辛[17].在儿童中,由于伦理问题,将采用更稀疏的抽样策略。
米替福辛的药代动力学将使用种群药代动力学方法进行建模和分析,例如,该方法可以估计受试者内部和受试者之间的变化。非线性混合效应建模将使用NONMEM统计软件包[18].除了比较参数估计的标准误差外,NONMEM提供的目标函数的最小值(等于log似然的负两倍)将被用作拟合优度特征。此外,模型的性能将通过标准拟合优度图进行评估。将逐步评估身体大小的协变量模型,以解释儿科和成人患者之间可能的差异,包括清除率的异速生长或线性缩放,以及按体重或无脂肪质量分布的体积。协变量模型的适当性将通过比较NONMEM给出的目标函数值和由此减少的各自药代动力学变量之间无法解释的变异性来评估。
药效学
为了评估治疗期间和治疗后的治疗反应,本研究将使用实时逆转录聚合酶链反应(qPCR)对血液寄生虫载量进行重复测量l . donovani基于单链18S rRNA扩增作为药效学(PD)标记的EDTA血液[19,20.].血液中寄生虫清除的差异在治疗组之间是可以预期的:组合可能导致更快速的消除利什曼虫寄生虫,因此缩短了治疗时间。在本试验中,血液寄生虫计数将被用作寄生虫清除率的PD标记,从而对治疗产生反应。
在接受米替福辛的组中,通过qPCR测量的结局和寄生虫清除率将与米替福辛药代动力学PK有关。对患者中米替福辛药代动力学PK/PD的建模将使我们能够建立与结局相关的药代动力学变性,这是开发新治疗方案的重要组成部分。
培训
所有试验现场工作人员;医生、护士、化验技术员及药剂师接受有关研究方案、研究具体程序及良好临床实践国际会议(ICH-GCP)指引的培训[21,22].将根据需要提供额外的培训课程,必要时使用外部顾问。接受培训的文件保存在协调中心。
质量控制和质量保证
经过GCP培训的合格临床监督员定期访问试验地点,监测试验的所有方面,包括:知情同意程序、药物问责、源数据验证、不良事件报告、样本处理、分析和安全数据存储。
数据收集和数据管理
数据将由现场调查人员记录在三部分无碳需求(NCR)病例报告表格(crf)上,从医院源数据转录而来。在随机分配时分配的唯一患者标识符与唯一的医院记录编号相关联。在监测访问期间,监测人员尽可能多地将CRF数据与医院源数据进行交叉检查。CRF每一页的顶页被带到中央数据中心,以双重输入符合GCP的开放存取数据库软件OpenClinica 2.7版[23]在分析数据之前,执行范围检查以检测数据输入处的异常值。验证后,数据将读入Stata, version 11特别版[14]和预先编入程序的命令文件,将在彻底的数据交叉核对过程中,生成数据值查询列表。查询表单将通过Microsoft Access自动生成©数据库软件,并通过电子邮件发送到试验点,复制到临床监视器。这些网站将打印并做出决议。在下一次监测访问时,监测员将核查解决方案并将其送交数据中心。数据修正将在Stata中编程,以完成数据清理审计跟踪。在分析时,检测到的任何异常值将在最终分析完成之前由调查人员在现场进行验证,以确认正确性/完整性。这也将在数据库锁定之前的数据管理报告中捕获。
出版政策
作为主办方,DNDi将为研究人员提供一切必要的协助,以确保在国际同行评议中及时发表结果,造福患者,并为VL治疗指南的国家决策提供信息。辅助研究将在适当的情况下注明患者的姓名。
保密
试验现场记录将包含每位患者的姓名和居住信息,以便进行随访。只有分配给患者的唯一数字标识符将从患者记录中提取并转移到数据中心。患者数据将在现场调查员的负责下安全地保存在试验现场。
审计
在试验过程中,将进行现场审计,以评估是否符合ICH-GCP指南。需要评估的具体问题包括遵守议定书和标准操作程序(SOPs)、同意、实验室实践、文件和记录保存。现场调查人员或试验协调中心将根据调查结果处理所有不符合规定的地方。
研究终止
在计划招募接近尾声时,试验协调办公室将通过电子邮件向每个站点发送关于停止招募日期的书面指示。所有患者将按照方案进行随访,并收集和清理数据。一旦数据锁定完成,将由协调小组和临床监测员进行现场清查。提前终止的决定将在与赞助商、调查人员和DSMB协商并达成协议后做出。所有相关的伦理委员会和监管机构也将被告知终止的原因。试验主文件和完整的crf文件将由内罗毕协调中心存档15年。
成果的传播
在每个组招募15名患者后,将向数据安全监测委员会(DSMB)提供一份简要的中期分析报告,介绍疗效,包括三角分析,该委员会的组成基于世卫组织-热带病预防规划指南[24].DSMB成员包括一名药理学家、儿科医生和一名流行病学家。有需要时,统计处会向外部统计员寻求意见。该报告还将包含分析日期之前发生的严重不良事件清单。不良事件清单应DSMB的要求提供。如果DSMB对试验行为或其他伦理和安全问题有顾虑,可以通过主席要求获得额外的有效性和安全性数据。
在试验结束时,临床研究报告将分发给首席研究员、DSMB、伦理委员会和卫生部。
伦理批准
在肯尼亚和苏丹开始试验之前,已获得国家和地方伦理委员会的伦理批准。LSHTM伦理委员会也批准了伦理批准,AMC医学伦理委员会发布了“不反对声明”。
组织
DNDi协调小组主要设在内罗毕的DNDi非洲协调中心、肯尼亚医学研究所,负责整理和提交议定书修正案、组织试验工作人员培训、监测和监督试验进行、试验的日常管理、收集在每个地点收集的数据、试验监测访问和数据管理,所有这些都符合GCP标准。
讨论
由于目前治疗方法的局限性,以及耐药性发展的风险,迫切需要在东非地区开发针对VL的短期联合治疗。该试验的目的是评估潜在的组合,然后在该地区的大型多中心iii期临床试验中进行评估。目前的试验还旨在收集更多的数据,以协助米替福辛在该地区的注册。出于这个原因,我们选择了三个独立的组,不进行组间比较,并包括一个专注于米替福辛治疗的PK/PD组件。由于该区域内药物反应的潜在地理差异,该试验旨在评估两个地点的治疗:一个来自东非疫源地北部(苏丹),一个来自东非疫源地南部(肯尼亚)[3.].为了提高开发效率、成本和时间,研究设计采用了三角检验。这也意味着选择了第28天的主要终点,因为较长的随访时间排除了这种三角试验的最佳使用。该设计还借鉴了在印度进行的第二阶段组合试验的经验[25].这项研究的重要潜在结果不仅包括米替福辛在该地区的注册,以及III期开发的药物组合的确定,而且还验证了一种设计,该设计可用于未来针对VL的新化学实体的药物开发过程。
缩写
- 跳跃:
-
利什曼病东非平台
- 即时通讯:
-
肌肉内的
- 四:
-
静脉注射
- PK:
-
药物动力学
- 帕金森病:
-
药效学
- 六世:
-
内脏利什曼病
- 个随机对照试验:
-
随机对照试验
- 公司:
-
钠stibogluconate
- PKDL:
-
后黑热病真皮利什曼病
- DSMB:
-
数据安全监察委员会
- CRF:
-
病例报告表
- 我:
-
国际协调会议
- 质量:
-
良好临床实践
- SOP:
-
标准操作程序
- NCR:
-
无碳排放
- VCT:
-
自愿辅导及测试。
参考文献
P:利什曼病。公共卫生方面和控制。临床皮肤病学杂志,1996,14(5):417-423。10.1016 / 0738 - 081 x(96) 00057 - 0。
Zijlstra EE, Musa AM, Khalil EA, el-Hassan IM, el-Hassan AM:后黑热病真皮利什曼病。中华流行病学杂志,2003,3(2):87-98。10.1016 / s1473 - 3099(03) 00517 - 6。
Hailu A, Musa, Wasunna M, Balasegaram M, Yifru S, Mengistu G, Hurissa Z, Hailu W, Weldegebreal T, Tesfaye S:东非内脏利什曼病对帕洛玛霉素反应的地理差异:一项多中心、开放标签、随机试验。科学通报,2010,26 (3):379 - 379 /journal.pntd.0000709。
Musa AM, Younis B, Fadlalla A, Royce C, Balasegaram M, Wasunna M, Hailu A, Edwards T, Omollo R, Mudawi M: Paromomycin治疗苏丹内脏利什曼病:一项随机、开放标签、剂量发现研究。科学通报,2010,34 (10):e855-10.1371/journal.pntd.0000855。
范·格里恩斯文,Balasegaram M, Meheus F, Alvar J, lyen L, Boelaert M:内脏利什曼病的联合治疗。中华流行病学杂志,2010,10(3):184-194。10.1016 / s1473 - 3099(10) 70011 - 6。
Ritmeijer K, Dejenie A, Assefa Y, Hundie TB, Mesure J, Boots G, den Boer M, Davidson RN:米替福辛和噻波葡萄糖酸钠治疗埃塞俄比亚HIV感染高发人群内脏利什曼病的比较。临床感染杂志,2006,43(3):357-364。10.1086/505217。
Bhattacharya SK, Sinha PK, Sundar S, Thakur CP, Jha TK, Pandey K, Das VR, Kumar N, Lal C, Verma N:米替福辛治疗印度内脏利什曼病的4期临床研究。中华流行病学杂志,2007,26(4):591-598。10.1086/519690。
Sundar S, Jha TK, Thakur CP, Engel J, Sindermann H, Fischer C, Junge K, Bryceson A, Berman J:口服米替福辛治疗印度内脏利什曼病。中华实用医学杂志,2002,22(3):389 - 397。10.1056 / NEJMoa021556。
Sundar S, Sinha PK, Rai M, Verma DK, Nawin K, Alam S, Chakravarty J, Vaillant M, Verma N, Pandey K:印度内脏利什曼病短期多药治疗与标准治疗的比较:一项开放标签、非劣性、随机对照试验。《医学杂志》,2011,377(9764):477-486。10.1016 / s0140 - 6736(10) 62050 - 8。
兰奇,李志刚,李志刚,李志刚。三角检验在阿奇霉素抗间日疟原虫复发临床试验中的应用。刘志军,刘志军。2002,(1):13-10.1186。
贝利森特E本绰J查唐C:三角检验在II期癌症临床试验中的应用。中华医学杂志,1999,9(8):907-917。10.1002 / sim.4780090807。
《序贯性临床试验的设计与分析》,1983,《中华人民大学学报》第1期
RDC团队:R:统计计算的语言和环境。2011,维也纳,奥地利:R统计计算基金会,http://www.R-project.org/
美国:Stata:数据分析和统计软件。1996,http://www.stata.com
阿米塔奇P, Berry G,马修斯JNS:医学研究的统计方法,2001,牛津:布莱克威尔科学出版物,4
Dorlo TP, van Thiel PP, Huitema AD, Keizer RJ, de Vries HJ, Beijnen JH, de Vries PJ:米替福辛在旧大陆皮肤利什曼病患者中的药代动力学。中国生物医学工程学报,2008,29(4):357 - 357。10.1128 / AAC.00014-08。
Dorlo TP, Hillebrand MJ, Rosing H, Eggelte TA, de Vries PJ, Beijnen JH:液相色谱-串联质谱法测定人血浆中米替福辛定量方法的开发和验证。中国生物医学工程学报,2008,29(2):344 - 344。10.1016 / j.jchromb.2008.02.005。
Beal S, Sheiner LB, Boeckmann A, Bauer RJ: NONMEM用户指南(1989-2009)。图标开发解决方案,2009年,美国马里兰州埃利科特城
de Vries PJ, van der Meide WF, Godfried MH, Schallig HD, Dinant HJ, Faber WR:用QT-NASBA量化米替福辛治疗内脏利什曼病的反应。中国生物医学工程学报,2006,29(3):344 - 344。10.1016 / j.trstmh.2006.01.002。
van der Meide W, Guerra J, Schoone G, Farenhorst M, Coelho L, Faber W, Peekel I, Schallig H:基于核酸序列的定量扩增、实时逆转录酶PCR和实时PCR定量利什曼原虫的比较。临床微生物学杂志,2008,46(1):73-78。10.1128 / JCM.01416-07。
人用药品注册技术要求协调国际会议(ICH)。http://www.ich.org/
世界医学协会赫尔辛基宣言:涉及人体的医学研究的伦理原则。http://www.wma.net/en/30publications/10policies/b3/17c.pdf
美国马萨诸塞州Akaza研究中心:OpenClinica:开源临床试验软件。2003,http://www.openclinica.org
世卫组织- tdr:数据和安全监测委员会的设立和运作业务指南,2005年,世卫组织- tdr,http://apps.who.int/tdr/svc/publications/tdr-research-publications/operational-guidelines
Sundar S, Rai M, Chakravarty J, Agarwal D, Agrawal N, Vaillant M, Olliaro P, Murray HW:印度内脏利什曼病的新治疗方法:单剂量脂质体两性霉素B,随后口服米替福辛。临床感染杂志,2008,47(8):1000-1006。10.1086/591972。
鸣谢及资助
DNDi用英国国际发展部(DFID)的捐款赞助了该试验;国际无国界药物组织/无国界医生组织;法国外交和欧洲事务部(MAEE);西班牙国际开发署,西班牙;以及个人捐赠者。我们感谢Peter Smith教授对试验设计的宝贵意见,也感谢Stuart Pocock教授对210天治疗分析的贡献。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
DNDi作为赞助者,正在资助试验、LEAP平台的维护费用和LEAP研究小组手稿的开放获取出版。MW, RO, SE和MB是DNDi的现有员工。
作者的贡献
所有作者均已阅读并批准最终稿。
LEAP研究组调查员(MW, EAGK和AM),来自LSHTM (NA, TE)的统计学家和来自赞助商DNDi (MB, SE)的代表设计了这项研究。RO, NA和TE起草了这份意见书。
所有其他LEAP研究组的作者在最终确定研究方案方面发挥了重要作用。
权利和权限
开放获取本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用归属许可协议(https://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
奥莫洛,R.,亚历山大,N.,爱德华兹,T.。et al。米替福辛单独和联合替葡糖酸钠和两性霉素B脂质体治疗东非原发性内脏利什曼病的安全性和有效性:一项随机对照试验的研究方案试用12, 166(2011)。https://doi.org/10.1186/1745-6215-12-166
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1745-6215-12-166
关键字
- 内脏利什曼病
- Miltefosine
- AmBisome®
- Tri-angular测试
- 协议
- 个随机对照试验