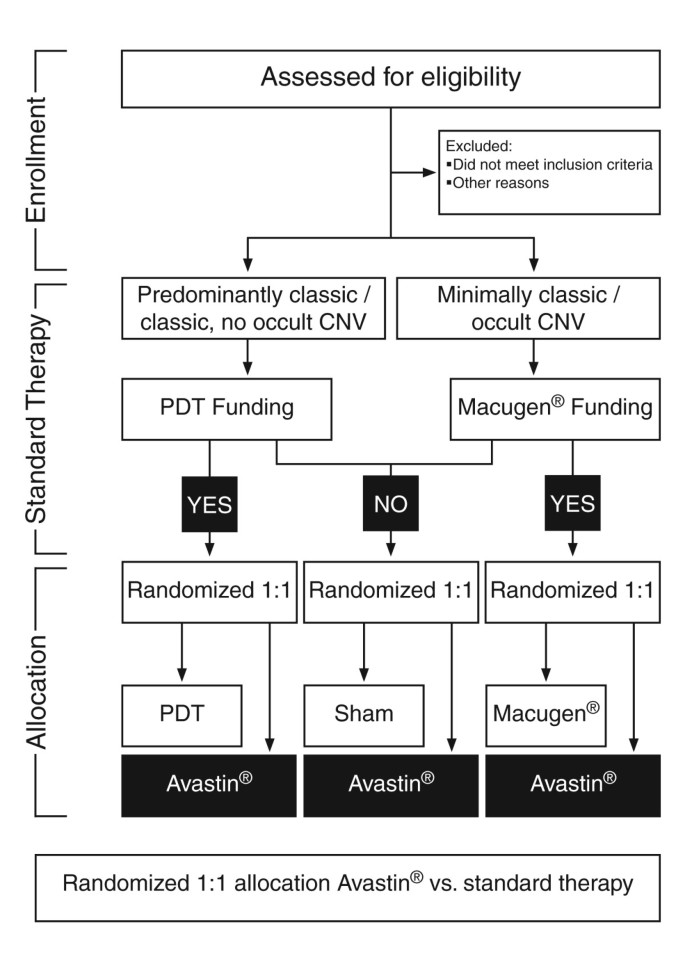
双盲随机对照试验,2个平行治疗组。符合条件的患者以1:1的比例随机接受玻璃体内贝伐珠单抗或标准治疗(PDT, pegaptanib玻璃体内注射或假玻璃体内注射)。每个患者只有一只眼睛被纳入研究,这是在随机化之前选择的。在试验登记之前确定标准疗法,此时患者通过最小化被分配到治疗组-这是一个动态过程,减少了试验组之间在标准治疗资格和部位方面的不平衡。在试验招募期间,根据国家健康与临床优化研究所(NICE)的指导,为定义明确(经典、无隐匿性或主要为经典CNV)的患者提供PDT资助。然而,对于定义不明确的nAMD(最低限度经典或隐匿性CNV)患者,由于PDT在自然史上没有显示出对这些病变亚型的疗效,并且新的抗vegf药物(pegaptanib和ranibizumab)没有经过NICE的评估,因此没有国家资助。国民保健服务(国民保健服务)的治疗是逐案提供的,许多病人没有得到国民保健服务治疗的资助。符合条件的具有最低限度经典或隐匿性无经典CNV的患者被随机分配到pegaptanib或虚假治疗(基于pegaptanib治疗的资助)。图中显示了抽样和随机化过程的概要1.
在试验招募的后期阶段,在雷珠单抗被引入临床实践后,如果患者获得了雷珠单抗的资助,他们将被排除在本次临床试验的注册之外。在本试验招募时,由于许多被拒绝接受公共治疗的患者没有医疗保险,无法负担私人治疗的费用,很大一部分患者仍未接受治疗,因此会考虑参与随机分为积极治疗组(玻璃体内贝伐单抗)或假组的试验。这种积极治疗与虚假或无治疗试验的先前先例包括pegaptanib VISION试验[4]或Lucentis MARINA试验[8].在NICE最终发布使用pegaptanib或ranibizumab治疗nAMD的NHS指南之前,ABC试验完全招募了其患者群体。
目标
主要的
为了验证在因年龄相关性黄斑变性(nAMD)而接受脉络膜新生血管(CNV)治疗的患者中,在12个月后,玻璃体内注射贝伐单抗比标准治疗更大比例的患者可以改善治疗眼的视力(定义为增加≥15个字母)
二次
为了验证以下假设:在因年龄相关性黄斑变性(nAMD)而接受CNV治疗的患者中:
- 1.
与标准治疗相比,玻璃体内注射贝伐单抗与12个月后眼部和全身不良事件的增加无关
- 2.
玻璃体内注射贝伐单抗在12个月后比标准治疗更大比例的患者可以稳定视力(定义为视力损失<15个字母)
- 3.
玻璃体内注射贝伐单抗在12个月后比标准治疗更大比例的患者可以改善视力(定义为增加≥10个字母)
- 4.
在6个月的时间点,玻璃体内注射贝伐单抗比标准治疗更能改善患者的视力
- 5.
与标准治疗相比,玻璃体内注射贝伐单抗可在12个月的时间点提高平均视力
- 6.
玻璃体内注射贝伐单抗在6个月和12个月的时间点比接受标准治疗的患者更能减少黄斑厚度
- 7.
在12个月的时间点,玻璃体内注射贝伐单抗比接受标准治疗的患者更能减少CNV的渗漏
资格
入选标准
- 1.
由于CNV的进展,在过去3个月内,最佳矫正视力因1条Snellen线或5个字母的早期治疗糖尿病视网膜病变研究(ETDRS)图表而恶化
- 2.
视网膜下或视网膜内有血
- 3.
近3个月荧光素血管造影显示病变面积增长超过10%
使用光学相干断层扫描(OCT)评估中央黄斑增厚的证据
病变总大小< 12个视盘区,包括所有相邻病变部分。
纤维化面积<病变总面积的25%
视网膜下血面积小于病变总面积的50%
最佳矫正视力,在研究眼中使用6/12至6/96的ETDRS图表(Snellen等效)
研究中只评估了一只眼睛。如果两只眼睛都符合条件,将选择视力较好的一只进行治疗和研究,除非基于医学原因,研究者认为另一只眼睛更适合治疗和研究。
排除标准
研究眼既往接受外束放射治疗、腋下热疗法(TTT)、热激光或PDT治疗
非研究眼在第0天前少于7天使用维替泊芬治疗,
以前参与过一项涉及抗血管生成药物(pegaptanib, bevacizumab, anecortave acetate,蛋白激酶C抑制剂等)的临床试验(用于任何一只眼)
既往玻璃杯体内药物输送(例如,玻璃体内皮质类固醇注射或装置植入)
研究眼有玻璃体切除手术史
有轻度非增殖性糖尿病视网膜病变或任何糖尿病黄斑病变病史
视网膜血管闭塞史(如果认为可能损害视力改善的潜力)
研究眼有青光眼滤过手术史
研究眼角膜移植史
研究对象有黄斑下病变手术史或其他手术介入史
在试验开始前1个月内曾参与任何试验药物的研究(不包括维生素和矿物质)
目前或打算使用华法林或已知血凝异常
病变特点
并发眼部疾病
研究者认为,在12个月的研究期内,任何同时发生在研究眼内的疾病(如白内障或糖尿病性视网膜病变)都可能需要药物或手术干预,以预防或治疗可能由该疾病引起的视力损失,或者如果放任其不加治疗,则可能导致在12个月的研究期内至少损失2条Snellen等效最佳矫正视力线
研究眼活动性眼内炎症(轻度或以上)
目前的玻璃体出血在研究的眼睛
研究对象有孔源性视网膜脱离或黄斑孔病史
双眼有特发性或自身免疫性葡萄膜炎病史
感染性结膜炎、角膜炎、巩膜炎或眼内炎
研究眼无晶状体或后囊缺失。既往研究眼的后囊侵犯也被排除在外,除非是由于YAG后囊切开术和之前的后房型人工晶状体植入术所致。
在研究眼中,屈光不正的球形当量显示出超过-8度的近视或屈光4-8度的病理性近视的迹象
对于研究眼先前接受过屈光或白内障手术的受试者,研究眼术前屈光误差不能超过-8度近视。
并发全身疾病
其他
所有因AMD而转诊到试验中心的活跃CNV患者均被告知临床试验并获得患者信息表。对那些渴望参与的患者进行筛选,并邀请符合资格标准的患者参加。这项研究是根据ICHGCP(临床研究良好临床实践国际协调会议)进行的,这是欧盟临床试验指令(2001)和相关的英国法规(2004)所规定的,它们遵循赫尔辛基宣言的原则。
干预措施
数字2总结试验治疗方法。
积极干预。玻璃体内注射贝伐单抗
贝伐珠单抗通过6周玻璃体内注射给药(剂量为1.25 mg / 0.05 ml /次注射),治疗策略为3次治疗,根据需要进一步注射,基于研究者驱动的再治疗和标准化的再治疗标准,反映了试验期间该药物的真实使用情况(54周内共注射3至9次)。贝伐单抗注射剂由Moorfields制药公司按照英国药品监管标准制备。
控制干预。玻璃体内注射聚aptanib
根据产品许可,这些药物的剂量为0.09 ml中的0.3 mg pegaptanib,作为连续治疗,每6周通过玻璃体内注射,持续1年(54周注射9次)。这反映了关键VISION随机对照试验中使用的剂量和治疗频率,该试验报告了pegaptanib治疗nAMD的有效性和安全性[4].
控制干预。维替泊芬光动力疗法
Verteporfin PDT可在其他地方进行[11].简而言之,一名未蒙面的试验成员未参与任何结果评估,并接受过保持蒙面重要性的培训,准备维替泊芬(6 mg/m)输注2根据患者的身高和体重计算体表面积后,用30毫升5%的葡萄糖。盖住输液管和泵保持遮盖后静脉滴注10分钟以上(溶液为绿色)。输注开始15分钟后,未戴面具的眼科医生使用激光(二极管激光689 nm) 83秒(光照50 J/cm)2,强度600mw /cm2),透过已知放大率的眼底隐形眼镜,向CNV病灶转移。每种治疗的激光光斑大小是通过在荧光素血管造影上测量CNV病变的最大线性直径,并添加1000 μm以在病变周围提供500 μm的额外边缘来确定的。治疗后,建议患者避免明亮的阳光48小时,以防止可能的光敏反应。
安慰剂治疗。假玻璃体内注射
与之前的随机对照试验一致[亚博ag出账秒到4,8],使用假玻璃体内注射,而不是安慰剂玻璃体内注射。假注射是通过遵循用于准备注射眼睛的程序来进行的,但不是玻璃体内注射,而是将一个空的1毫升注射器的轮毂牢牢地应用于结膜,以模拟主动注射。该手术在道德上是可以接受的,因为它不会使患者遭受与玻璃体内注射相关的威胁视力的感染的潜在风险,同时通过类似于主动注射手术来保持掩蔽。
保持掩蔽的措施
安慰剂PDT
这用于标准治疗为PDT的随机使用贝伐单抗的患者。该程序与活性维替泊芬PDT相同,只是使用5%的葡萄糖作为安慰剂,不添加维替泊芬。这与之前的研究一致[11].注意确保静脉输液泵和静脉输液管被覆盖,因为活性维特泊芬溶液为绿色,而安慰剂输液液为透明溶液。
额外使用假注射
由于随机接受贝伐单抗或pegaptanib治疗的患者的治疗涉及重新治疗(贝伐单抗)与连续给予的治疗(9、6周玻璃体内注射pegaptanib)的比较,以保持遮盖,基于标准化的再治疗标准,对随机接受贝伐单抗的患者在该次就诊时(第18至48周)不需要玻璃体内治疗。这是为了保持掩蔽,因为pegaptanib是作为连续治疗提供的(根据产品许可),而贝伐单抗是作为3次初始注射,并根据必要的标准化再治疗标准进行进一步治疗。
评估掩码成功与否
当患者离开研究时,通过问卷调查的方式评估掩模的充分性,以确定对治疗分配的看法
结果测量
主要的
- 1.
视力评分
视力的改善定义为在12个月的时间点与基线相比,使用ETDRS视力表和在4米起始距离的视力测量,获得15个字母或更多(3行)的最佳矫正视力评分。
二次
- 1.
其他基于视力的结果
除了常规的视力增加15个或更多字母的终点外,最近有临床试验建议视力增加10个或更多字母的终点[12因此,在贝伐单抗治疗组和标准治疗组中,使用该终点改善视力的患者比例也将作为6个月和12个月时间点的次要结果测量进行描述和分析。最佳矫正视力评分增加5个或更多字母的患者和减少15个字母的患者比例的其他替代终点也将作为次要终点进行类似的检查。两组在12个月时视力的平均变化也将被报告。
- 2.
基于光学相干层析成像的视网膜厚度测量
使用Stratus OCT (Carl Zeiss Meditec, Inc)使用快速黄斑厚度映射扫描协议获得视网膜厚度测量。每次就诊时采用径向线扫描(不能进行径向线扫描时采用十字线扫描)来确定是否存在黄斑积液(视网膜内囊肿和视网膜下积液)。报告贝伐单抗组和标准治疗组在6个月和12个月时点黄斑厚度的平均变化。
- 3.
对比灵敏度测量
使用pli - robson图表测量对比敏感度[13].
- 4.
阅读能力测试
明尼苏达阅读(MNREAD)表[14通过测量最大阅读速度、临界打印尺寸和阅读敏锐度来评估阅读能力。
不良事件
这些将被记录在案,严重的不良事件将报告给药品和保健产品监管机构(MHRA)。将注意到眼部和全身不良事件。还将有一份符合抗血小板试验工作者合作(APTC)标准的任何不良事件的具体报告[15].由于这是一项双蒙面试验,不良事件将由数据监测委员会(DMC)审查,DMC可能要求揭开蒙面以进行治疗分配。
探访时间表及评估
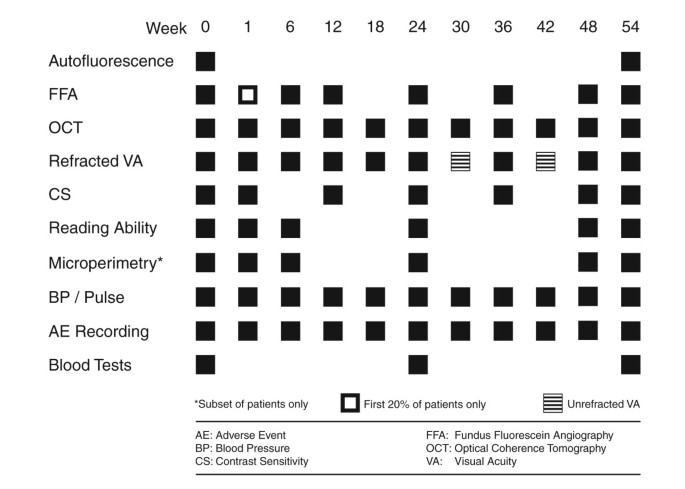
随机分组和治疗发生在筛查访问后14天(或同一天)。基线治疗后,患者在第1周再次进行安全随访(未给予治疗)。在第6周、第12周、第18周、第24周、第30周、第36周、第42周和第48周进行重复治疗的进一步随访。研究出口访视发生在第54周(1年)。这规定了9次治疗访视,其中前3次玻璃体内贝伐单抗治疗是强制性的(基线,第6周和第12周),根据标准化的再治疗标准(第18周,第24周,第30周,第36周,第42周,第48周),需要进一步治疗。安全性评估包括记录所有不良事件,在基线、第24周和研究结束(第54周)时监测血压和脉搏并进行血检。
研究评估包括功能结果评估,包括最佳矫正视力评估、对比敏感度测量和阅读能力测量(使用MNREAD视力表)。在每次就诊时,通过OCT测量视网膜厚度和CNV活性的定性特征评估结构结果。在基线、第6周、第12周、第24周、第36周、第48周和第54周随访时进行眼底荧光素血管造影(第1周对前20%的患者进行额外的荧光素血管造影),以评估CNV大小和泄漏的任何变化。图中总结了试验访问情况3..
试验规模
具有0.050双侧显著性水平的Fisher精确检验将有90%的能力检测第1组比例π之间的差异1,为0.300,π为第2族比例2当每组样本量为57时,为0.060。考虑到随访中12%的潜在损失,我们计划每个治疗组招募65名患者。(以前的nAMD临床试验[4,11],表明多达10%的患者可能在试验期间失去随访)。有了这些数字,我们将有82%的能力检测出0.25和0.06的差异。
统计分析
将总结每个治疗组患者的基线特征。在12个月时,每组中获得15个字母或更多的最佳矫正视力(BCVA)的患者比例将通过精确二项式方法计算95%置信区间。将进行费雪精确检验,以评估这些比例中观察到的差异是否具有统计学意义。将报告优势比和95%置信区间,以说明贝伐单抗和标准治疗之间的对比。如果发现任何预后因素的不平衡,将进行逻辑回归,以评估任何不平衡的影响和调整的优势比报告。数据将根据患者最初被分配到的组(即治疗意图)进行分析。除了治疗分析的意图外,还将进行每个方案的分析。
每组中6个月和12个月的患者比例
- 一)
获得5个BCVA字母
- b)
获得10个或更多的BCVA字母
- c)
BCVA丢失不到15个字母
将报告95%置信区间,并描述12个月时OCT测定的黄斑中心厚度和BCVA的平均变化。比较结果(优势比和平均差异)也将以95%的置信区间报告。这些构成了试验的次要终点的一部分。
将构建Kaplan Meier图来检查BCVA的改善率,并进行Cox回归或log秩检验。将对比例风险假设的遵守情况进行评估。
不良事件将按治疗组列表。
审判组织
试验中心和调查人员列于表中1
试验督导委员会
试验指导委员会对试验进行监测和监督,并对任何拟议的重大议定书修正案提出意见(见表1)1).
数据监察委员会
数据监测委员会(DMC)包括2名对视网膜疾病有专业兴趣的独立眼科医生和1名具有临床试验经验的独立统计学家(表2)1).没有正式的中期分析计划。试验统计学家将向独立的数据管理委员会报告,该委员会将对试验的所有方面进行监测。它将每月审查安全数据,并在适当的情况下进行安全分析。
审判行动委员会
由首席研究员、协调中心首席研究员和试验经理组成的运营委员会每周开会。在这些会议期间,委员会审查了研究的进展,确定所有3个地点的任何问题或问题。
审判的协调
该试验由Moorfields眼科医院的临床试验部门(CTU)集中协调。它提供电话随机化服务(使用最小化)并负责数据管理。
试验文件和数据收集
向所有试验中心提供议定书、标准操作程序指南、源文件和病例报告表格。严重不良事件报告给Moorfields眼科医院(试验发起人)和MHRA。
道德规范和主管部门审查
向英国主要和地方研究伦理委员会(REC)提出的申请已获得好评,MHRA已颁发了临床试验授权。
出版政策
无论结果是否有利于试验干预,该试验的结果将提交给同行评审的医学杂志发表。
试验时间表
试验开始
2006年8月
试招完成
2007年11月
试验结束
2008年12月
试验持续时间
2年5个月
每个病人参与的时间
1年(54周)