摘要
背景
对植入心脏设备的患者进行磁共振成像(MRI)目前被认为是危险的,因为对患者和起搏器系统存在潜在的电磁干扰。全球每年进行约6000万次MRI扫描,估计大多数心脏起搏器患者在其心脏起搏器使用期间可能会出现MRI适应证,这表明在MRI环境中安全使用心脏起搏器具有临床价值。一种新型起搏系统(美敦力EnRhythm MRI™SureScan™和CapSureFix MRI™导联)已被设计并进行了临床前测试,可在MRI环境中安全使用。EnRhythm MRI研究旨在确认这种新型起搏系统的安全性和有效性。
方法
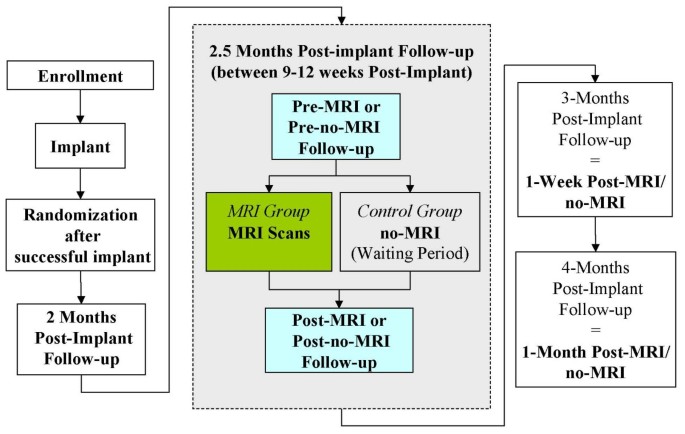
EnRhythm MRI研究是一项前瞻性、随机对照、非盲临床试验,旨在确认在1.5特斯拉MRI下对植入专门设计的起搏器和导联系统的患者的安全性和有效性。患者具有双腔起搏器植入的标准适应症。在起搏器系统植入后9-12周,成功植入的患者以2:1的比例随机接受MRI (MRI组)或未进行MRI扫描(对照组)。磁共振(MR)扫描包括14个头部和腰椎扫描序列,代表临床相关扫描,同时最大限度地提高梯度回转率,最高可达200 T/m/s,和/或发射射频(RF)功率最高可达SAR(特定吸收率)水平,即2 W/kg体重(正常工作模式的上限)。MRI组在装置植入时、每次随访时、MRI前后和对照组在同一时间点测量所有设备信息和传感和捕获功能的完整询问。MRI和对照组患者也在扫描后一周和一个月进行完整的起搏器和导联评估。
主要终点是安全且成功地完成MRI扫描,这是通过MRI操作相关并发症的自由度以及导联传感和捕获功能的临床显著变化来衡量的。
结果
大约156名和470名患者完成4个月的随访后,将通报结果。
试验注册
ClinicalTrials.gov标识符:NCT00433654。
背景
磁共振成像(MRI)对心脏起搏器和其他植入设备的患者目前是禁忌的,因为这种诊断方法对活动植入物有潜在的危险[1].然而,这些和其他老年患者对MRI的需求增加了[2].全球每年进行大约6000万次MRI扫描,估计大多数心脏起搏器患者在其心脏起搏器的生命周期内可能需要进行MRI检查,这表明在MRI环境下安全使用心脏起搏器具有临床价值。
一些研究报告称,少数心脏起搏器患者在受控情况下并采取一定的预防措施进行了核磁共振扫描。只有在风险收益比被认为是可接受的情况下才会这样做。然而,用核磁共振扫描起搏器患者并非没有风险。在德国,六名非起搏器依赖患者在没有任何监测的情况下,在一次核磁共振检查中死亡。在其中3例病例中,有提示性证据表明死亡可能是由于诱发性心室颤动[3.].其他研究表明,起搏阈值从mri检查前到检查后显著增加[4,5].此外,动物试验表明,在对心脏进行核磁共振扫描时,铅尖端的温度上升至20°C [6],这可能导致组织损伤。
可以设计起搏器系统来限制MRI对患者的潜在风险。这样的设计已经实现,促使临床试验在有和没有磁共振成像的情况下测试其功能。由于目前所有可用的起搏器系统都被禁止在MRI中使用,由EnRhythm MRI™SureScan™起搏器和CapSureFix MRI™Model 5086引线组成的新型起搏系统在MRI环境中安全使用。该起搏系统是市售EnRhythm的改进版本®起搏器和CapSureFix®诺维斯5076型领先。本文报告了该心脏起搏器系统的评估研究的设计。
对起搏器的设计进行了改进,以最大限度地减少引线和电极放电的能量。对硬件进行了更改,以确保在MRI活动时可靠运行。导线被改变以减少来自射频(RF)的导线尖端加热。导线和设备上有不透光的标签,表明植入的系统可用于MRI。此外,起搏器可以被编程为MRI SureScan模式,以允许在MRI扫描期间发挥适当的功能。在这种模式下,医生可以选择异步起搏模式或非起搏模式。异步起搏将在整个MRI检查过程中保持适当的起搏支持,而不考虑起搏系统上的噪声。对于那些不依赖起搏器的患者,可以使用非起搏模式。MRI SureScan模式操作期间暂停诊断数据收集、自动系统监测测量、房性心律失常检测和房性心律失常治疗。此外,在对MRI模式进行编程之前,该系统加强了医生仔细检查起搏器患者接受MRI检查所需的安全要求。
研究设计
该研究是一项前瞻性、随机对照、无盲、多中心研究性试验,在美国、加拿大、欧洲和中东的约75个中心进行。在植入美敦力EnRhythm MRI SureScan系统(美敦力EnRhythm MRI™SureScan™起搏器和美敦力CapSureFix MRI™导联)后,患者需要在2个月、2.5个月(植入后9-12周之间进行MRI扫描或非MRI扫描,取决于随机)、3个月(MRI后1周/非MRI)和4个月(MRI后1个月/非MRI)进行随访。在植入后6个月和之后每6个月进行进一步随访,直到研究结束。MRI组在植入时、每次随访、MRI前后即刻以及对照组在同一时间点测量所有设备信息和阻抗、传感和捕获功能。该系统必须植入超过6周,才能使植入式脉冲发生器(IPG)在患者进行MRI扫描之前形成稳定的起搏和感知功能。
由于MRI对捕获和感知测量的影响尚不清楚,因此选择了并发对照组设计。在本研究中观察到的效果理论上是由于所有患者共同的捕获和感知参数的自然变化之和,加上MRI检查的效果。如果没有随机对照组,就不可能将MRI的影响与所有使用IPG系统的患者的共同成分隔离开来。由于核磁共振扫描而导致的电测量的可能差异正是研究人员希望了解的。
包含/排除标准
使用以下in-/exclusion标准。标准的选择主要是为了符合心脏起搏器系统的标识。
入选标准
根据美国心脏病学会(ACC)/美国心脏协会(AHA)/心律学会(HRS)指南,有I或II类适应症的患者需要植入双腔起搏器[7].
患者必须能够接受胸骨植入。
能够并且愿意在没有镇静的情况下进行择期MRI扫描的患者(允许进行抗焦虑治疗)。
地理位置稳定,在研究期间可在研究中心进行随访的患者。
排除标准
需要获得合法授权代表同意的患者。
机械三尖瓣心脏瓣膜患者
三尖瓣疾病患者包括瓣膜置换术。
单次1.0 mg醋酸地塞米松可能是禁忌症的患者。
曾经植入过心脏起搏器或植入过心脏起搏器/除颤器的患者。放弃起搏器/ICD导联者除外;然而,全系统外植的患者也可纳入。
需要ICD而不是起搏器的患者。
目前指征或预期有指征的患者在研究要求的随访期间接受除研究中具体描述的外的另一种MRI检查。
既往植入有源医疗器械的患者(上述患者除外)。
使用非mri兼容设备(上述设备和其他如神经刺激器)或植入材料(如非mri兼容胸骨线、生物刺激器、金属或合金)的患者。
患有排除方案要求的测试或限制研究参与的疾病的患者。
在本临床试验期间参加或打算参加另一项临床试验(研究药物或设备,批准药物或设备的新适应症,或超出标准临床实践的额外测试要求)的患者。
孕妇,或有生育潜力但没有采取可靠避孕措施的妇女。
符合当地法律规定的排除标准(如年龄、哺乳)的患者。
起搏器植入和测量
被植入的设备是5086 MRI CapSureFix®主动固定可同时用于右心房和右心室。通常采用经锁骨下静脉、腋窝静脉或头静脉的右胸或左胸入路引入导联,然后将导联推进到研究人员在心脏中选择的位置,以感知和捕获心房和心室心肌。EnRhythm MRI SureScan IPG连接到胸骨部位的导联。
植入后,在心房和心室分别测量0.2和0.5 ms脉冲持续时间的电压刺激阈值、阻抗和传感振幅。研究者完成一份关于植入过程中导线处理特性的调查问卷。
磁共振扫描时的测量结果如下所述。在每次必要的随访中进行起搏器功能的进一步测量。
随机化
患者最初计划以1:1的比例随机分组,但后来在试验中,在成功植入EnRhythm MRI SureScan起搏系统后,该比例被修改为2:1,接受MRI扫描(MRI组)或不接受MRI扫描(对照组)1).预计超过60%的植入患者将以1:1的顺序随机分组,其余患者将以2:1的顺序随机分组。调整了比例,以满足最低扫描患者数量的监管要求。
核磁共振成像扫描
随机接受磁共振扫描的患者在植入后9-12周进行成像。MRI组的每位患者进行了14次临床相关的脑和腰椎MR扫描(MRI总调查时间约为45分钟,MRI总活动扫描时间约为30分钟)。根据MRI SureScan起搏系统的标签,所有MRI研究都在1.5特斯拉系统下进行,每个单独MR序列的梯度系统的转换速率(“梯度dB/dt”)限制在200 T/m/s,每个单独MR序列的射频暴露限制在2 W/kg体重或更低的特定吸收率(SAR)。此外,标签要求射频线圈的等中心位于第一颈椎椎体(C1)之上或第十二胸椎体(T12)之下。所使用的序列是由该研究的扫描咨询委员会精心选择的,用于临床应用,并且在不同的市上1.5 T闭式孔MRI扫描仪(制造商GE、西门子、飞利浦)之间具有相似性,包括使用高梯度回转率和/或产生接近心脏起搏器系统标记极限的高SAR的序列。一些已经具有高梯度转换速率的MR扫描协议被修改,以最大限度地提高梯度曝光,达到系统限制,如果可能的话,达到200 T/m/s。此外,为了在腰椎扫描中最大化梯度暴露,患者被放置的方式(即,射频线圈的等中心位于L1和S1),预计起搏系统部位的感应电压最高。至少一次腰椎扫描应达到高SAR值。在执行第一次研究患者扫描之前,每个中心都需要对所有扫描进行验证,以确保每个特定部位的扫描方案在不同部位之间具有可比性。
在扫描过程中,患者至少要通过脉搏血氧仪进行持续监测。口头交流也发生评估或确认任何重大临床变化。在MRI扫描开始前和MRI扫描完成后,立即在心房和心室测量电压刺激阈值,传感振幅和阻抗。
虽然临床研究包括一组固定的脑和腰椎序列,但EnRhythm MRI起搏器系统的MRI扫描要求使得可以对C1和T12内的解剖区域进行诊断性MRI扫描,同时通过改变某些MRI参数将射频线圈的等中心置于该区域之外。
研究目的
本文将分析两组目标。第一项研究将在大约156名患者植入这种新型起搏器系统后进行分析,并随访4个月,为美敦力在美国以外的市场发布提供数据;第二项研究将在大约470名患者植入这种新型起搏器系统后进行分析,并在接受这种新型起搏器系统后进行4个月的跟踪,以满足监管要求。
关于156例植入和随访患者的第一组目标描述如下:
a)主要目标
- 1.
评估起搏系统、MRI和植入手术相关的并发症从植入到MRI后1个月是否大于80%。采用95%置信区间的单侧精确检验进行分析。
不良事件(AE)是与起搏系统相关的,如果它是由被研究系统的存在或性能引起的。如果是由MRI过程中发生的研究性起搏系统和MRI系统之间的相互作用引起的,包括患者在受试者4个月随访(MRI后1个月)中处于MRI系统5高斯线内的时间,则声发射或不良设备效应与MRI程序相关。此外,由于受试者的MRI编程而发生的ae将被认为与MRI程序相关。AE是与植入手术有关的,如果是由于植入手术引起的。AE被归类为并发症,如果它导致侵入性干预或终止重要的设备功能,而不管其他治疗。静脉注射和肌肉注射药物治疗被认为是侵入性治疗。
- 2.
比较MRI组和对照组在MRI/非MRI前和一个月后0.5 ms时心房和心室电压刺激阈值的变化。阈值的变化用于指示潜在的心肌热损伤。假设将检验两组之间的变化是否在统计上等效(Δ = 1 V)。采用双侧置信区间进行分析。
- 3.
比较MRI组和对照组在MRI/非MRI后1个月房室感觉振幅的差异,统计比较MRI对这些参数的影响。假设将检验感觉振幅是否具有统计学等效性(Δ = 1.7 mV心房,5.0 mV心室)。采用双侧置信区间进行分析。
为了通过这项研究的第一次分析,需要满足所有3个主要目标。
b)次要目标
所有次要目标和附加分析都使用描述性统计进行分析,但不进行统计评估。
- 1.
确认是否遵循了完成MRI扫描的标签说明,以确保患者安全。由于标签的不足或使用标签的不足而发生与系统相关的不良设备效应。
- 2.
MRI扫描中所见的持续性室性心律失常和心室停搏的发生特征。
- 3.
描述所有植入手术、起搏系统和MRI手术相关的并发症,并观察植入术后4个月的情况。
- 4.
总结植入后4个月心房和心室导联阻抗。
- 5.
描述CapSureFix MRI引线模型5086 MRI的引线处理与市售型号5076的关系。采用7点问卷调查。
- 6.
描述MRI组和对照组4个月起搏阈值和感觉振幅与市售先导5076型相关。
c)附加分析
- 1.
演示EnRhythm MRI SureScan起搏系统(包括发生器和引线)可以被x射线MRI标记(图2).采用7点问卷调查。
在470例患者植入后,随访4个月,第二次分析包括以下目标:
a)主要目标
- 1.
评估MRI后一个月MRI相关无并发症率是否大于90%。采用单侧精确检验,置信区间为97.5%。
- 2.
比较MRI组和对照组在MRI/非MRI前和一个月后0.5 ms时a)心房电压阈值和b)心室电压阈值的变化。该假设将检验患者的比例(p1和p2),经历可接受的阈值增加小于或等于0.5 V是等效的(Δ = 10%, p1和p2= 96%)。目标将使用双样本97.5%置信区间进行分析,p值来自法林顿-曼宁比例等价检验。
- 3.
比较MRI组和对照组在MRI/非MRI前和1个月后a)房感振幅和b)心室感振幅的变化。该假设将检验患者的比例(p1和p2),感觉振幅下降小于50%,且在mri /非mri后一个月感觉振幅仍高于临床可接受的最低值(心房1.5 mV,心室5 mV)的患者是相同的(Δ = 10%, p1和p2= 93%)。目标将使用双样本97.5%置信区间进行分析,p值来自法林顿-曼宁比例等价检验。
为了通过研究,需要满足第二组的所有3个主要目标。
b)次要目标
除了上面列出的第一个分析的六个次要目标外,进一步的目标将描述种植手术和4个月随访之间的所有系统相关并发症,以确认无并发症率大于80%。目标分析采用单侧精确检验,置信区间为95%。
系统相关并发症、引线处理和引线性能的次要目标在“固定顺序方法”下进行评估,以保持这些目标的总体第一类误差,以用于监管目的。用正式的统计检验对三个目标进行了顺序检验。铅处理使用95%置信区间进行分析,以评估EnRhythm MRI队列与5076历史对照组(Δ = 1.5个单位)之间总体铅处理特征的差异是否具有统计学等效性。采用95%置信区间分析导联性能,以分析EnRhythm MRI队列与5076历史对照组在捕获和感知方面的差异是否具有统计学等效性(Δ =捕获0.5 V,心房感知0.9 mV,心室感知2.5 mV)。
c)附加分析
除了上面为第一个分析列出的附加分析之外,进一步的分析将总结MRI SureScan编程模式的异常或不良行为,为此收集有关其使用和性能的信息。
此外,还将提供MRI扫描时是否遵循了安全措施和程序的摘要。收集有关心脏病学和放射科团队在MRI扫描前后是否遵循了准备、编程和监测的保障措施和程序的信息。
样本大小和用于分析的数据使用
两组目标的样本量计算都排除了损耗,并提供至少80%的功率,第一类错误率(alpha)为0.05(第一组)或0.025(第二组)。这两种分析不需要alpha调整,因为目标是不同的,而且两组分析都只分析一次。考虑到估计的研究损耗和增加的监管要求,每个主要目标和最大要求(第一组每组62例,第二组每组122例)的样本量分别增加到156例和470例。
研究计划中列出了预先指定的分析排除标准,包括以下内容:
mri访问窗口期后1个月以外的访问数据不包括在捕获和感测目标的主要分析中,但包括在这些目标的次要敏感性分析中。
未按方案要求进行MRI扫描的患者的数据被排除在捕获、感觉、MRI相关并发症、标记说明、心律失常发生和导线阻抗的分析之外。
房性心律失常患者在电数据采集时的数据不包括在受影响就诊时的心房捕获和感知目标分析中。
未解决的铅脱患者的数据被排除在捕获、传感和阻抗目标分析之外。
来自MRI检查前起搏阈值差异超过0.5 V的患者的数据(这表明导联/组织界面异常)被排除在捕获和传感目标的分析之外。
缺乏所需阈值条文档或未在0.5 ms测量的起搏捕获数据将被排除在捕获阈值目标的分析之外。
无法捕获的患者将在受影响就诊时被分配一个6v的捕获阈值,以计算描述性统计。
独立咨询委员会
研究者将被要求评估每个不良事件与起搏系统、植入程序和/或MRI扫描的关系。不良事件咨询委员会(AEAC)将定期审查所有不良器械影响、死亡、技术观察和不良事件的分类。
扫描咨询委员会为三个制造商的不同MRI机器开发了类似的MRI扫描协议,并协助验证单个MRI扫描。此外,该委员会将定期审查所进行的MRI扫描,并确定所获得的扫描数据是否将包括在分析中。
该试验由一个独立的数据监测委员会(DMC)监督,该委员会由一名统计学家、一名放射学家和一名心脏病学家组成,负责审查安全性数据以及定期审查疗效数据。
道德方面
研究将根据调查计划、关于医学研究的《赫尔辛基宣言》以及患者入选国的当地法律和法规进行。每个研究中心都需要机构审查委员会/医学伦理委员会批准研究方案,并在入组前获得患者的书面知情同意。患者可以在任何时候退出研究,无需给出理由,也不会危及他们的进一步治疗。如果符合患者的最佳利益,研究者也可以让患者退出。
讨论
本研究旨在确认MRI环境下新型起搏系统的安全性和有效性。
关于MRI扫描对植入设备患者的影响,以及如何最大限度地减少这些危害的建议,已发表了许多工作[4- - - - - -6,8- - - - - -15].这些报告的推论表明,需要专用的起搏系统来避免包括心律失常、起搏输出抑制和触发刺激,以及在电极/组织界面存在潜在热损伤的起搏导线rf相关加热等并发症,尽管对这种需求仍存在一些争议[3.].为了在MR环境中安全使用而设计的系统必须考虑到在全球范围内对所有类型的患者进行的MR研究数量迅速增加。植入装置患者目前在临床上明显处于不利地位,因为在他们可能出现的许多情况下无法安全地进行MRI检查。
一种新的系统已经设计出来,以解决MRI扫描植入装置患者的安全问题。这需要仔细的临床评估,这是本试验的目标,使用随机化技术对将被扫描的患者和不被扫描的对照组进行扫描。
在未来,如果这项试验成功,人们希望mri兼容性可以扩展到更复杂的设备,例如提供心脏再同步治疗和植入式心脏除颤器的设备。
缩写
- ACC:
-
美国心脏病学会
- 啊哈:
-
美国心脏协会
- AE:
-
不良事件
- AEAC:
-
不良事件咨询委员会
- C1:
-
颈椎1
- DMC:
-
数据监察委员会
- 小时:
-
心律学会
- ICD:
-
植入式心脏除颤器
- IPG:
-
植入式脉冲发生器
- 先生:
-
核磁共振
- 核磁共振成像:
-
磁共振成像
- 病人:
-
胸椎12
- 我们:
-
美国
- 特别行政区:
-
比吸收率。
参考文献
Levine GN, Gomes AS, Arai AE, Bluemke DA, Flamm SD, Kanal E, Manning WJ, Martin ET, Smith JM, Wilke N, Shellock FS:美国心脏协会诊断和介入心导管委员会;美国心脏协会临床心脏病学委员会;美国心脏协会心血管放射学和干预委员会。心血管设备患者磁共振成像的安全性:来自诊断和介入心导管委员会、临床心脏病学委员会和心血管放射学和干预委员会的美国心脏协会科学声明:由美国心脏病学会基金会、北美心脏成像学会和心血管磁共振学会批准。流通,2007,116:2878-2891。10.1161 / CIRCULATIONAHA.107.187256。
Dewey M, Schink T, Dewey CF:磁共振成像安全相关禁忌症患者的转诊频率。中国生物医学工程学报,2007,29(3):344 - 344。10.1016 / j.ejrad.2007.01.025。
Irnich W, Irnich B, Bartsch C, Stertmann WA, Gufler H, Weiler G:我们需要抗磁共振成像的起搏器吗?科学通报,2005,27(3):353- 353。10.1016 / j.eupc.2005.02.120。
Sommer T, Naehle CP, Yang A, Zeijlemaker V, Hackenbronch M, Schmeidl A, Meyer C, Strach K, Skowasch D, Valhaus C, Litt H, Schilt H:非起搏器依赖患者1.5 T胸外MRI安全性能策略:一项包含115项检查的前瞻性研究《中国科学院学报》,2006,34(4):344 - 344。10.1161 / CIRCULATIONAHA.105.597013。
王志强,王志强,王志强,王志强:磁共振成像与心脏起搏器安全性的关系。中华心脏外科杂志,2004,29(4):457 - 457。10.1016 / j.jacc.2003.12.016。
Luechinger R, Zeijlemaker VA, Pedersen EM, Mortensen P, Falk E, Duru F, Candinas R, Boesiger P:磁共振成像中起搏器引线的体内加热。中华心脏杂志,2005,26:366 - 366。10.1093 / eurheartj / ehi009。
Gregaratos G, Abrams J, Epstein AE, Freedman RA, Hayes DL, Hlatky MA, Kerber RE, Naccarelli GV, Schoenfeld MH, Silka MJ, Winters SL, Gibbons RJ, Antman EM, Alpert JS, Gregoratos G, Hiratzka LF, Faxon DP, Jacobs AK, Fuster V, Smith SC: ACC/AHA/NASPE 2002心脏起搏器和抗心律不全装置植入指南更新:美国心脏病学会/美国心脏协会/北美起搏和电生理工作组关于实践指南的报告。流通,2002,106:2145-2161。cir.0000035996.46455.09 10.1161/01.。
fan P, Shein M:食品和药物管理局视角:植入式心脏复颤除颤器患者的磁共振成像。《中国科学院学报》,2006,34(4):344 - 344。10.1161 / CIRCULATIONAHA.106.647800。
Del Ojo JL, Moya FL, Villalba J, Sanz O, Pavón R, Garcia D, Pastor L:磁共振成像对心脏起搏器接受者安全吗?起搏临床电生理。2005,28:274-278。10.1111 / j.1540-8159.2005.50033.x。
Gimbel JR, Kanal E:植入式心脏起搏器患者可以安全地接受磁共振成像吗?中华心血管病杂志,2004,43:1325-1327。10.1016 / j.jacc.2004.02.009。
Gimbel J, Bailey R, Shane M, Tchou PJ, Ruggieri PM, Wilkoff BL:起搏器依赖患者安全磁共振成像策略。起搏临床电生理。2005,28:1-6。10.1111 / j.1540-8159.2004.09533.x。
Naehle CP, Sommer T, Meyer C, Strach K, Kreuz J, Litt H, Lewalter T, Schilt H, Schwab JO:植入式心脏除颤器患者磁共振成像安全性能策略。起搏临床电生理。2006,29:113-116。10.1111 / j.1540-8159.2006.00285.x。
Prasad SK, Pennell DJ:心血管植入物和设备患者的心血管磁共振安全性。《心脏杂志》,2004,30(4):344 - 344。10.1136 / hrt.2003.021154。
Nazarian S, Roguin A, Zviman M, Lardo L, Dickfield T, Calkins H, Weiss R, Berger R, Bluemke D, Halperin H:使用1.5特斯拉的永久性起搏器和植入式心脏除颤器的患者的非心脏和心脏磁共振成像方案的临床实用安全性。《中国科学院学报》,2006,34(4):344 - 344。10.1161 / CIRCULATIONAHA.105.607655。
Shellock F, Fischer L, Fieno D:心脏起搏器和植入式心脏除颤器:1.5特斯拉体外磁共振成像。中华心血管杂志2007,9:21-31。10.1080 / 10976640600897237。
作者信息
作者及隶属关系
相应的作者
额外的信息
相互竞争的利益
RS, EKl, DB, RLr和TS是美敦力的顾问公司。BW是一名顾问,科学顾问委员会的成员,收取版税,并从美敦力公司获得其他研究支持。IJ和MH都是美敦力的雇员。
作者的贡献
RS和IJ撰写了这篇论文,并将其提交给其他作者,后者回复了评论和修订。所有作者都对本研究的设计做出了贡献。美敦力(Medtronic)是这项研究的赞助商,该研究是与所有作者合作设计的。
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、传播和复制,前提是正确地引用原始作品。
关于本文
引用本文
萨顿,R.,卡纳尔,E.,威尔科夫,B.L.et al。新型美敦力EnRhythm MRI SureScan起搏系统对患者磁共振成像的安全性:临床研究设计试用9, 68(2008)。https://doi.org/10.1186/1745-6215-9-68
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/1745-6215-9-68
关键字
- 磁共振图像
- 比吸收率
- 系统速度
- 植入式脉冲发生器
- 起搏器系统