摘要
目的
为了为大流行期间对未来临床试验的监督提供信息,我们总结了数据监测委员会(DMC)对COVID治疗试验随机评估(RECOVERY)的经验,这是一项针对COVID-19住院患者治疗的大规模随机适应性平台临床试验。
方法和发现
在试验的前24个月(2020年3月至2022年2月),DMC监督了14项成人治疗(加上10项儿童治疗)的累积数据,涉及45000名随机患者。DMC发挥作用的五个关键方面是:一个庞大的成员委员会,包括一些具有广泛的DMC经验和其他具有广泛的临床专业知识的成员;由试验主要研究者进行清晰的战略规划、沟通和响应;能够应付迅速征聘阶段的数据收集和分析系统,并与电子健康记录相联系;有能力与监管机构(和其他dmc)建设性合作,解决新出现的问题,而不需要发布无盲死亡率结果;视频会议系统的使用使国家和国际成员能够在大流行期间在不可能举行实体会议的情况下,在短时间内召开会议。挑战包括,前四种疗法实际上是在“竞争”患者(增加了对每种疗法快速做出决定的压力);在报告研究结果的全球卫生必要性与保持保密的必要性之间取得平衡,直到结果足够确定,以便为治疗决定提供适当的信息;并可靠地评估安全性,特别是对于在最初的浪潮之后引入的新药物以及包括少量孕妇和儿童在内的药物。我们提出了一系列的案例插图来说明一些问题和DMC的决策与羟氯喹,地塞米松,卡西瑞维单抗+ imdevimab和托珠单抗。
结论
RECOVERY的精简自适应平台设计与医院级和人群级健康数据相关联,能够对COVID-19住院患者的多种治疗方法进行快速可靠的评估。后来引入的因子评估提高了试验的效率,而不影响DMC评估安全性和有效性的能力。当数据不成熟时,要求向监管机构发布无盲的主要结果数据,DMC需要与监管机构进行重大沟通,以避免不适当的早期试验终止。
简介
随机试验的数据监测委员会(DMC)是独立于试验研究人员的一组个人,他们负责确保试验中患者的安全,以及治疗可能受到试验结果影响的未来患者的安全[1,2].DMC通过定期审查中期、无盲数据,然后向试验调查人员提出建议,说明试验是否应按计划继续进行,还是因益处或危险的证据而提前终止。由独立的DMC提供的监督对于在艾滋病毒/艾滋病流行或COVID-19大流行等突发公共卫生事件期间进行的试验尤为重要[3.].然而,DMC在这种情况下的有效运作也带来了一些具体的挑战。RECOVERY试验是(在撰写本文时仍然是)一项大规模随机适应性平台试验,评估在COVID-19住院患者中广泛适用的治疗方法(见http://www.recoverytrial.net/).当前的论文由RECOVERY DMC的成员撰写,描述了我们的一些工作,这些工作在某种程度上超出了典型DMC的“常规”经验:我们希望这些例子可以为未来试验的DMC操作以及那些设计、实施和规范临床试验的人所采取的方法提供信息。尽管这些例子都与COVID-19大流行有关,但所吸取的经验和教训也适用于更普遍的试验。
方法
在试验的前两年(2020年3月至2022年2月),RECOVERY评估了14种不同的成人治疗方法,迄今为止发表了10篇论文[4,5,6,7,8,9,10,11,12,13].下面,我们总结了其中四种治疗(羟氯喹、地塞米松、卡西瑞维单抗+ imdevimab和托珠单抗)的决定(关于这些和其他评估治疗的进一步信息在附加文件中提供1).然而,我们首先描述了试验的一些方面,这些方面对其成功至关重要,或者对DMC提出了特别的挑战。表1而且2总结这些挑战,以及未来dmc的一些经验教训,以及那些设计、实施和监管大流行临床试验的人所采取的方法。
具有适当专业知识的DMC的快速试验设置和启动
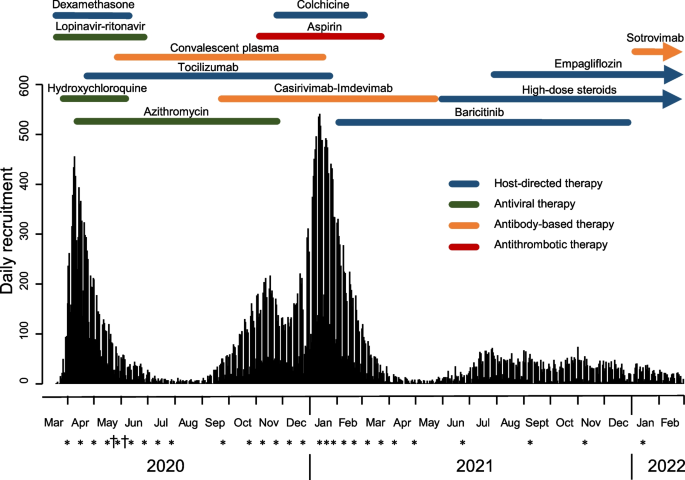
鉴于2019冠状病毒病(COVID-19)大流行即将于2020年初在英国爆发,该试验在极短的时间内获得批准并召开了DMC会议。试验的主要研究人员试图尽快建立试验,以便在英国因COVID入院的患者数量开始上升时开放招募。研究人员于2020年3月9日开始起草方案,3月13日将其提交伦理和监管部门批准,并于3月19日对第一例患者进行随机分组。试验方案可在www.recoverytrial.net.今后24个月的每日征聘率见图。1.2020年3月23日,英国政府宣布全国封锁。DMC于3月31日首次召开会议,当时已经招募了来自30家英国医院的151名患者。DMC的成员由试验首席研究员提名,包括在DMC工作和大规模临床试验方面具有丰富专业知识和经验的人员,以及具有相关临床专业知识的医生[14].dmc的大小不同,但通常包括6个或更少的个体。然而,对于恢复,选择了一个规模稍大的DMC,以满足所需的专业知识范围,处理工作可能的复杂性,并在DMC成员自身因COVID-19(或其他疾病)不适时提供一定的弹性;到目前为止,DMC还没有包括患者或患者倡导者。这种经验和专门知识从一开始就证明是非常宝贵的。两名新成员于2022年加入,以进一步扩大医疗专业知识的多样性。所有成员都宣布了任何潜在的利益冲突。从一开始,视频会议系统的使用就使会议能够在短时间内安排,便于国家和国际成员参加,并使减灾委员会能够在大流行期间在家工作时高效地举行公开和闭门会议。所有会议都在网上进行。牛津大学(试验赞助商)保护我们免受任何法律诉讼,我们可能面临履行DMC章程中概述的角色(附加文件)1).我们不负责选择或建议新的治疗方法进行评估,我们的工作也没有报酬。
清晰的战略规划和沟通,灵活的样本量方法
Pogue [15]和DeMets [16]强调了DMC必须做出的复杂决定取决于来自研究首席研究员(或指导委员会)和准备DMC报告的数据团队的清晰、简明和及时的沟通。在《恢复》中,研究人员为试验提供了一个明确的战略框架,该框架定期适应不断变化的大流行。重要的是,在每次DMC会议的公开会议上,调查人员简要更新了试验进展、预计的COVID-19严重病例数、来自其他试验的外部信息、他们的计划以及指导委员会的任何决定。(指导委员会列在试验方案中,包括试验首席调查员和牛津大学内外的其他研究学者。)他们希望试验能够产生足够可靠的证据来改变全世界的做法,而最初的样本量只是“尽可能多”。DMC章程(见附加文件)1)没有规定硬性的“停止规则”。相反,它只是简单地写着,DMC将确定,在他们看来,该研究中的随机比较是否提供了足以影响国家和全球治疗策略的死亡率证据(结果的不确定性范围足够小)[17].这一措词以及《宪章》的所有其他方面都得到了减灾委员会成员的核可。主要终点为28天死亡率。对于试验初始阶段包括的四种干预措施(洛匹那韦-利托那韦、地塞米松、羟氯喹、阿奇霉素),研究人员和DMC了解到,每两名患者分配常规护理,每一名患者分配每种治疗,每次评估可能需要数千名患者。(每分配一种治疗方案,就随机安排两名患者接受常规治疗,确保每种治疗方案都能可靠地与基本上重叠的对照组患者进行比较。)到2020年5月中旬,情况已经很清楚,28天的总死亡率约为25%。研究人员随后建议我们,每个活动臂分配2000名患者,而每个活动臂自己的对照组分配4000名患者(即仅进行常规护理)将需要在双尾提供90%的功率p= 0.01以检测约五分之一的比例减少。
DMC会议的频率
在2020年3月31日的第一次会议上,每日招聘人数迅速增加(图2)。1),而且预计至少在未来几周甚至几个月里都将处于高水平。因此,我们与调查人员商定了最初每两周开会一次的时间表。我们考虑了多个中期评估对用于显著性检验的最终I型误差水平的潜在影响,假设我们不会考虑为获益而建议早期停止治疗,除非有获益至少死亡率降低3到3.5的标准误差(与宪章中使用的语言一致,即证据应该足够有力影响国家和全球治疗战略) [18,19].这表明,对每种治疗进行10次甚至20次中期评估,对总体I型错误率的影响微乎其微。因此,会议每两周举行一次,直到2020年7月30日的第9次预定会议,之后随着2020年夏季英国疫情放缓,会议频率有所降低。总的来说,在第一年,我们安排了22次DMC会议和2次紧急审查会议(这两次会议都是应英国药品和保健产品监管机构[MHRA]的具体要求安排的:见下文)。
高招聘率:可扩展的常规数据联动系统的价值
在试验的前几个月,我们可以获得的主要结果数据来源是医生和护士在出院、死亡或28天(以较早者为准)时填写的随访表格。在第一个高峰(2020年4月)期间,招募人数超过400人/天,而在第二个高峰(2021年1月)期间,招募人数超过500人/天(图2)。1).因此,在某些时候,很多随访信息(特别是非致命性结果)是不完整的,仅仅是因为患者尚未达到随机分组后28天。然而,随着试验的继续进行,数据团队能够使用常规医疗保健数据来补充当地工作人员记录的数据,这种数据与作为常规NHS护理和国家登记处一部分生成的中央数据集相关联。(RECOVERY现在利用来自这些常规数据源的超过25个不同的数据集。)广泛的数据连接确保了随访的高完成率,并避免了床边数据收集过程在高峰期间不堪重负的风险。使用常规医疗保健数据集还可以确定当地研究团队无法可靠记录的结果(例如,当参与者在医院之间转移到重症监护设施时)。这些数据系统还使试验统计小组能够在完成治疗比较后很快报告结果。(例如,地塞米松的招募工作于6月8日结束,初步结果仅在8天后报告并广泛宣传)。
简明及时的统计分析报告给DMC的价值
在每次预定的DMC会议前约48小时,对数据进行整理和核对,不考虑治疗分配。数据系统在试验协调办公室内设置了适当的防火墙,以确保中期结果不会因疏忽而泄露给调查人员。DMC中包括两名非盲统计学家和无投票权统计学家(JRE和NS),他们各自独立编程和运行分析,然后在每次会议前交叉检查结果(任命两名非盲统计学家的部分原因是为了确保其中一人因COVID而患病,另一人可以继续工作)。DMC报告应是一套简明的表格和图表,内容应限于与DMC决策过程最相关的信息[15,16].对于每一项干预措施,我们的DMC报告仅包括少量页面,显示随时间推移的累积招募、基线特征、入院期间接受的治疗、28天Kaplan-Meier死亡率曲线(主要结果),以及一个详细的表,展示了治疗分配对所有预先指定的疗效和安全性结果的影响。随着新的干预措施的加入,相关的安全评估也随之增加。随着每项干预措施招募的成熟,还提供了根据基线特征对主要结局(28天死亡率)进行的亚组分析,以及显示中期恢复结果的荟萃分析以及所有其他可用的相关试验的结果。
在公开试验中保持结果盲化的保密性和重要性
协议规定指导委员会、研究工作人员、研究人员、研究参与者、资助者和其他合作伙伴将对研究结果的中期结果保持保密,直到最后一位患者被随机分配到特定干预组后28天为止。维持中期DMC结果的盲化是必要的。任何故意或无意地公布DMC未明目的中期结果都可能妨碍试验的顺利完成,并肯定会损害这一至关重要的试验监督机构的诚信。然而,有几次,英国监管机构MHRA要求DMC暂停招募或提供关于全因死亡率主要结果的无盲安全信息,以进行持续的比较。我们遵循广泛接受的原则,即对主要结果和会议记录的无盲DMC分析不会出于监管或审计目的而披露,因为当负责审查的监管科学家不是非盲监测过程的一部分时,对试验数据的监管审查是最客观的[20.].如果监管机构(或DMC之外的其他个人)获得了部分未盲数据,可能会导致某些治疗部门不适当地过早关闭。此外,试验的完整性可能会受到损害,特别是如果这些信息无意中或以其他方式传播到与试验结果有关的个人手中,他们可能会根据不成熟的数据发表误导性的推论。因此,出于患者安全、透明度和科学问责的考虑,MHRA对每一项无盲数据的请求都得到了及时处理(通常在正常工作时间之外),并通过讨论解决,而没有披露无盲中期初步结果(见附加文件)1这些交互的细节)。然而,我们有时允许向监管机构发布关于特定次级安全结果的非盲安全信息。机密的交流定性然而,当其中一个或两个委员会出于安全考虑考虑放弃一种药物时,与其他dmc测试类似治疗的试验信息是有用的(见补充文件)1).
安全性评估
在RECOVERY试验中,收集到的与安全性相关的信息包括原因特异性和全因死亡率(主要结局),有创机械通气和肾脏替代治疗的使用,以及与正在研究的干预措施相关的特定不良事件。例如,在第一波早期,当人们担心羟氯喹可能导致心律失常时,相关字段被添加到28天结果表中。同样,当恢复期血浆和casirivimab + imdevimab加入治疗组时,记录有关输血/输注反应的信息,当随后加入阿司匹林时,记录血栓和出血事件。恢复资格标准使孕妇随机接受试验中测试的几种治疗。虽然纳入的孕妇数量相对较少(前两年有98名),因此仅在这一亚人群中就没有任何有意义的结果,但我们经常向我们提供孕妇及其妊娠结果的所有相关结果的表格。儿童也有资格接受适当的康复干预,在前两年,335名儿童被随机分组。我们特别审查了所有儿童的结果。
兵种间招募的“竞争”、无用性和阶乘设计的价值
在大流行开始时,英国新型和新兴呼吸道病毒威胁咨询小组优先评估了几种治疗方法。因此,RECOVERY利用“多臂”设计的优势,允许同时评估四种治疗方法(洛匹那韦-利托那韦、地塞米松、羟氯喹、阿奇霉素)[21].然而,这也意味着这些干预措施有效地相互“竞争”参与者。大流行的最初一波有一个非常急剧的高峰,因此在前8-10周后,每日招聘人数迅速下降(在这一点上,不确定英国是否会复苏,以及在多大程度上复苏)。因此,我们需要考虑在一种备受瞩目的治疗方法中获得略微更令人信服的阴性结果,与可能招募更多患者加入另一组最终可能产生有益效果的患者,以及在仍有大量病例的情况下添加另一种治疗方法之间的权衡。对于羟氯喹和地塞米松,考虑到效应大小的不确定性,研究人员最初并没有指定任何无效分析的标准。然而,随着第一波病例缓解和招募减缓,研究人员(一直不知道任何中期结果)确实要求我们审查洛匹那韦-利托那韦的无效分析,并在较晚的时间内审查秋水仙碱的试验(见附加文件)1详情)。2020年4月,当托珠单抗被添加到试验中(以及之后的大多数新干预措施)时,干预措施是以阶乘的方式添加的,从而避免了“竞争”问题。这对后来的一些比较也有有益的影响——对应于更适度的效应量的预期——更大的样本量可以累积,因此也提供了治疗组合的信息。例如,在2020/2021年冬季,有超过1万名患者被招募到阿司匹林和秋水仙碱与常规治疗的阶乘比较中,这对正在招募的恢复期血浆或casirivimab+imdevimab患者没有任何影响。
审判过程中的决策
对于正在研究的一些干预措施,我们的决策过程相对简单,但对于其他一些干预措施,则出现了需要进行大量讨论才能解决的具体问题。下面总结了四个例子。(更多关于这些决定的细节,以及更直接的决定的摘要,在附加文件中有详细说明1).
关于羟氯喹的决定
在大流行的早期阶段,公众对羟氯喹在治疗COVID-19感染中的价值进行了激烈的辩论。2020年3月28日,美国食品和药物管理局(FDA)发布了羟氯喹治疗COVID-19患者的紧急使用授权(EUA),但迫切需要可靠的随机证据。到2020年5月13日,当1387名患者被分配到羟氯喹,2813名患者被分配到常规护理时,分配到羟氯喹的效果显示,28天死亡率略有不显著增加,28天内活着出院的患者较少。考虑到我们的研究范围(特别是需要提供足以影响国家和全球治疗战略的证据),以及试验指导委员会计划在羟氯喹组至少2000个样本量,我们认为没有修改方案的令人信服的理由。然而,我们对这种模式有一些担忧;DeMets将这种担忧描述为“令人痛苦的负面趋势”,在这种情况下,最好的选择往往是允许更多的数据积累[22].在那次会议后不久,我们受到了来自MHRA的压力,在对治疗效果进行可靠估计之前,我们终止了招募。5月22日发表在《柳叶刀》上的一篇关于COVID-19住院患者的大型非随机多国登记的报告估计,在对多个测量混杂因素进行调整后,羟氯喹的使用与34%的死亡率增加相关(HR 1.34, 95% CI 1.22至1.46)[23].MHRA致函主要研究人员,声明立即停止羟氯喹组的招募(《柳叶刀》的报告后来被撤回,但直到2020年6月5日才停止[23])。主要研究人员要求我们紧急审查当前的数据。在一个公共假日周末,经过与MHRA的大量讨论和互动,MHRA要求但没有提供主要结果的无盲分析,招募被允许继续进行。6月4日,观察到的对死亡率的影响是这样的,即使是适度的益处也被有效地排除了,即使没有对无效进行正式的分析,因此我们建议研究人员对羟氯喹的结果不盲目(5月22日至6月5日宣布的事件的其他细节在补充文件中描述1).主要研究者结束了对羟氯喹组的招募,并在第二天宣布了初步结果[24].FDA于2020年6月15日撤销了羟氯喹的EUA,并在此后迅速更新了国家和国际指南。
关于地塞米松的决定
随着分配使用地塞米松的患者数量接近其计划样本量(2000例患者),28天死亡率总体下降和活着出院比例增加的趋势开始出现。到5月28日DMC会议时,1998年分配地塞米松患者的数据可用,尽管分配地塞米松与28天死亡率降低14%相关(2p = 0.0098),基线需氧量有明显的质性相互作用,表明基线时不需要补充氧气的患者有明显的危害。因此,重要的是,在揭开试验小组的面纱和作出任何公开宣布之前,应完成后续工作。调查人员于2020年6月8日关闭了地塞米松组的招募,当时该组达到了计划的2000个样本量。对最终数据的分析显示,地塞米松在随机分组中将需要补充氧气的患者的28天死亡率显著降低了约五分之一,在随机分组中将需要有介入机械通气的患者的28天死亡率降低了约三分之一,但在随机分组中没有降低不需要补充氧气的患者的死亡率[4].调查结果于2020年6月16日公布[25,26并立即在全球范围内对COVID-19最严重患者的治疗产生了影响。
关于高危亚组随机使用卡西瑞维单抗的决定+imdevimab
2020年10月30日星期五,Regeneron制药公司通知RECOVERY调查人员,他们对单克隆“抗体鸡尾酒”casirivimab+imdevimab的COV-2066试验进行的独立数据安全监测委员会建议,由于潜在的安全问题,暂停对任何需要高流量氧气或通气的住院患者的招募。调查人员通知了MHRA,并立即发布了一份声明,指出RECOVERY将继续按计划招募,但整个DMC将在6天后的2020年11月5日审查数据,届时我们建议继续招募。随后,在MHRA、研究人员和我们之间进行了一系列交流,讨论我们是否有义务向MHRA发布未盲的主要疗效和安全性数据(见补充文件)1).11月7日,RECOVERY DMC主席与COV-2066试验DMC主席进行了秘密讨论,使RECOVERY DMC能够建议继续招募卡西瑞维单抗+依德维单抗组的所有亚组。尽管如此,MHRA继续要求获得支持该决定的无盲数据。经过进一步的通信,澄清了审查的结果列表以及总体和关注的亚组(两个治疗组相加)的患者和死亡人数,MHRA接受了我们不提供无盲主要结果数据的立场。在此期间进行的通信交流突出了避免外部影响DMC决策的重要性,但也有可能使负责保护公众利益的监管机构放心,同时保持机密性,保护数据的完整性和维护DMC的决策过程。当最终结果可用时,这些结果显示血清阴性患者的获益一致,无论基线时接受的呼吸支持水平如何[12].
关于如何采取行动的决定在关于tocilizumab的新闻发布会后
2020年11月19日,预定的RECOVERY DMC会议当天,REMAP-CAP研究人员发布了一份新闻稿,指出在前303名随机接受免疫调节治疗(托珠单抗、sarilumab、anakinra、干扰素或无免疫调节剂)的患者中,托珠单抗与无免疫调节相比具有较高的统计学确定性(99.75%的概率托珠单抗优于无免疫调节),与无免疫调节相比,托珠单抗具有更好的结果;这种明显的好处的性质和规模没有说明。此时,RECOVERY的托珠单抗部门招募了1858名患者(其中438例死亡);鉴于这些数据以及新闻稿中缺乏细节,我们建议继续招聘。在2020年12月17日的DMC会议上,RECOVERY调查人员告知我们,他们不仅在总体上寻求明确的答案,而且在接受地塞米松治疗的患者亚组中也寻求明确的答案。在这次会议上,我们的报告还包括了在对所有可用的托珠单抗随机试验进行荟萃分析的背景下对RECOVERY结果的介绍。由于所有证据都是不确定的,很明显,RECOVERY需要达到其计划的样本量才能提供明确的答案,我们再次建议继续招募。基于4116例患者的最终结果可靠地证实了REMAP-CAP的死亡率结果,但重要的是也证实了接受地塞米松的患者的获益[9].
总结
减灾委员会的责任负担是众所周知的,在大流行病的情况下更是如此[3.,27].恢复试验DMC的责任在于平衡谨慎和速度:谨慎地等待足够的证据积累,以得出强有力的结论,并迅速确定哪些治疗明显无效,哪些明显有益。我们需要尽早为全球数百万COVID-19患者的护理提供信息。在这样一个占据主导地位的新闻领域负责这样一项备受瞩目的试验带来了额外的压力,例如,需要对其他(通常是规模小得多、信息量少得多的)试验的中期结果迅速做出反应,这些试验通常以新闻稿或发表在知名期刊上的非随机研究的有限形式进行。为了使减灾委员会及时作出知情的决策,工作强度很大,这给试验小组的所有成员以及减灾委员会成员带来了相当大的负担。在新生儿医学试验的背景下提到了DMC在压力下“保持镇定”的必要性[28];我们的情况就是这样。我们曾多次紧急响应监管部门的要求,公布无盲检测结果;每一次,经过相当大的努力,我们都能够提供信息来解决他们的问题,而不需要提供未盲的结果,因此我们能够保持数据的完整性和机密性。
数据和材料的可用性
试验方案,DMC章程和其他材料可在https://www.recoverytrial.net/
参考文献
临床试验中的数据和安全监测委员会。博卡拉顿:查普曼和霍尔/CRC生物统计学系列,CRC出版社;2009.
艾伦伯格SS,弗莱明TR,德梅茨DL。临床试验中的数据监测委员会:一个实用的观点。奇切斯特:威利;2002.
DeMets DL, Fleming TR.在COVID临床试验中实现dmc的有效知情监督。临床流行病学杂志,2020;126:167-71。
恢复合作小组。地塞米松在COVID-19住院患者中的应用。中华医学杂志,2015;29(4):344 - 344。
恢复合作小组。羟氯喹对新型冠状病毒肺炎住院患者的疗效观察。中华医学杂志(英文版),2010;
恢复合作小组。洛匹那韦-利托那韦在COVID-19住院患者中的应用(恢复):一项随机、对照、开放标签的平台试验。柳叶刀》。2020;396(10259):1345 - 52。
恢复合作小组。阿奇霉素在COVID-19住院患者中的应用(恢复):一项随机、对照、开放标签的平台试验。柳叶刀》。2021;397(10274):605 - 12所示。
恢复合作小组。COVID-19住院患者的秋水仙碱(恢复):一项随机、对照、开放标签的平台试验。中华医学杂志2021;9(12):1419-26。
恢复合作小组。Tocilizumab用于COVID-19住院患者(恢复):一项随机、对照、开放标签的平台试验。柳叶刀》。2021;397(10285):1637 - 45。
恢复合作小组。COVID-19入院患者的恢复期血浆(恢复):一项随机对照、开放标签、平台试验。柳叶刀》。2021;397(10289):2049 - 59。
恢复合作小组。COVID-19住院患者服用阿司匹林(恢复):一项随机、对照、开放标签的平台试验。柳叶刀》。2022;399(10320):143 - 51。
恢复合作小组。Casirivimab和imdevimab用于COVID-19住院患者(恢复):一项随机、对照、开放标签的平台试验。柳叶刀》。2022;399(10325):665 - 76。
恢复合作小组。Baricitinib在COVID-19住院患者中的应用(恢复):一项随机、对照、开放标签、平台试验和更新的荟萃分析。柳叶刀》。2022;400(10349):359 - 68。
Grant AM, Altman DG, Babiker AB, Campbell MK, Clemens FJ, Darbyshire JH,等。数据监测和试验中期分析中的问题。卫生技术评估。2005;9(7):1-238 (iii-iv)。
波格J,萨克特DL。临床试验轮:23轮。当RCT的数据中心报告将重要信息淹没在数据海洋中时:Waldo在哪里?临床试验。2014;11(5):601-4。
DeMets DL, Wittes J.数据监测委员会中期报告:我们必须尽快到达那里!临床试验。2022;19(1):107-11。
恢复试验指导委员会。恢复协议v1.0(2020-03-18)[可从:https://www.recoverytrial.net/files/protocol-archive/recovery-protocol-v1-0-2020-03-18-final.pdf.
Haybittle杰。癌症治疗临床试验结果的反复评估。中国生物医学工程学报。2001;29(4):344 - 344。
Peto R, Pike MC, Armitage P, Breslow NE, Cox DR, Howard SV,等。设计和分析需要长时间观察每位患者的随机临床试验。一、介绍与设计。中华肿瘤学杂志,2002;34(6):585-612。
Ellenberg SS, Fleming TR, DeMets D.数据监测委员会运作的监管考虑。在:临床试验中的数据监测委员会:一个实际的角度。奇切斯特:威利;2002.
Parmar MK, Carpenter J, Sydes MR.需要更多的优越性多臂随机试验。柳叶刀》。2014;384(9940):283 - 4。
DeMets DL, Pocock SJ, Julian DG。临床试验监测中令人痛苦的消极趋势。柳叶刀》。1999;354(9194):1983 - 8。
梅赫拉,鲁奇兹卡,帕特尔安。羟氯喹或氯喹加或不加大环内酯治疗COVID-19:多国登记分析柳叶刀。2020;395(10240):1820(撤回https://doi.org/10.1016/s0140 - 6736 (20) 31180 - 6, 2020)。
牛津大学。新闻稿:在COVID-19住院患者中使用羟氯喹没有临床益处。可以从:https://www.recoverytrial.net/files/hcq-recovery-statement-050620-final-002.pdf.
英国广播公司。冠状病毒:地塞米松证明2020年首个救命药物[可从:https://www.bbc.co.uk/news/health-53061281.
牛津大学。新闻稿:低成本地塞米松可将COVID-19严重呼吸道并发症住院患者的死亡率降低多达三分之一[可从:https://www.recoverytrial.net/files/recovery_dexamethasone_statement_160620_v2final.pdf.
阿姆斯特朗PW,卡利夫RM。数据与安全监察委员会的学分在哪里到期?中华医学会医学杂志,2013;31(4):344 - 344。
斯诺登C,布罗克赫斯特P,塔斯克RC,沃德·普拉特M,埃尔伯恩d,“在DMC上你必须保持勇气。”新生儿重症监护试验数据监测委员会面临的挑战:来自BRACELET研究的定性描述。PloS one。2018; 13 (7): e0201037。
确认
最重要的是,我们要感谢参与这项试验的数千名患者。我们也要感谢加纳、印度、印度尼西亚、尼泊尔、南非和越南参与的医院的许多医生、护士、药剂师、其他联合卫生专业人员和研究管理人员,以及176个英国国家卫生服务医院组织,他们得到了国家卫生研究所(NIHR)临床研究网络、NHS数字系统、英国公共卫生部、卫生和社会福利部的工作人员的支持,重症监护国家审计和研究中心,苏格兰公共卫生,苏格兰国家记录服务,斯旺西大学的安全匿名信息链接,以及英格兰、苏格兰、威尔士和北爱尔兰的NHS。DMC感谢Martin Landray, Peter Horby和Richard Haynes对草稿的有益评论。
研究组织
RECOVERY试验是一项由研究者发起的、单独随机、开放标签的对照试验,旨在评估一系列假定治疗方法对COVID-19住院患者的疗效和安全性。该试验由来自纳菲尔德人口健康系的临床试验服务部门和国家围产期流行病学临床试验部门的一个小组协调,以及试验发起人牛津大学纳菲尔德医学系牛津流行病研究小组。国家卫生研究所临床研究网络为当地的现场活动提供了支持。英格兰国家保健服务和英格兰公共卫生部门支助向当地诊所提供治疗。对相关常规医疗保健和登记数据的访问得到了NHS数字化、重症监护国家审计和研究中心、苏格兰公共卫生部、苏格兰国家档案局和斯旺西大学的安全匿名信息链接(SAIL)的支持。
资金
RECOVERY试验得到了英国研究与创新(UKRI)和NIHR(资助参考MC_PC_19056)、英国卫生和社会保障部(DHSC)、UKRI和NIHR COVID-19快速反应基金(COV19- RECPLA)以及威康信托基金会(资助参考222406/Z/20/Z)通过COVID-19治疗加速项目向牛津大学提供的资助。核心资金由国家卫生研究院牛津生物医学研究中心、惠康、比尔和梅林达·盖茨基金会、外交、联邦和发展部、英国卫生数据研究、医学研究理事会人口健康研究部门、国家卫生研究院新发和人畜共患感染健康保护部门以及国家卫生研究院临床试验部门支持资金提供。Combiphar免费提供秋水仙碱用于印度尼西亚的这项试验。艾伯维提供了一些洛匹那韦-利托那韦供本试验使用。该试验由罗氏产品公司免费提供Tocilizumab。Casivirimab和imdevimab由Regeneron公司免费提供。本出版物中表达的观点是我们自己的,不一定是NHS或NIHR的观点。
作者信息
作者及隶属关系
贡献
PS和JRE编写了初稿。所有作者都对该草案和随后的草案发表了评论。所有作者都同意了最终的手稿。
相应的作者
道德声明
伦理批准并同意参与
该试验的伦理批准由剑桥东部研究伦理委员会提供(参考文献:20/EE/0101)。获得所有患者的书面知情同意,如果他们无法提供同意,则从他们的法定代表那里获得。
发表同意书
所有作者都看过并批准了最终版本,并同意将其提交出版。
相互竞争的利益
PS是牛津大学纳菲尔德人口健康系赞助的ORION-4研究的DMC主席,他为此收取费用和费用。DD是美国国立卫生研究院、食品和药物管理局以及制药和医疗器械行业在临床试验的设计、监测和分析方面的顾问。他曾在多个行业赞助的数据和安全监测委员会任职,包括阿斯利康、安进、Actelion、Bristol Meyers Squib、DalCor、GSK、默克、赛诺菲、波士顿科学、美敦力、Mesoblast、Intercept、杜克临床研究所和汉密尔顿人口健康研究所。他没有持有任何制药或设备公司的股票。JD, RF, DL, MM, NS, AW, JW和JRE声明他们没有竞争利益。所有作者都没有收到在RECOVERY DMC服务的任何报酬。
额外的信息
出版商的注意
怎么样下载亚搏施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
附加文件1。
在线附录。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可协议中,除非在材料的信用额度中另有说明。如果材料未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。如欲查看本牌照的副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条所提供的资料,除非在资料的信用额度中另有说明。
关于本文
引用本文
Sandercock, p.a.g., Darbyshire, J., DeMets, D.。et al。RECOVERY试验数据监测委员会的经验,这是一项针对COVID-19住院患者治疗的大规模适应性平台随机试验。试用23, 881(2022)。https://doi.org/10.1186/s13063-022-06824-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s13063-022-06824-6